
已知:Fe2O3 (s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=234.1kJ·mol-1
CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则2Fe(s)+ O2(g ) = Fe2O3(s) 的△H是
O2(g ) = Fe2O3(s) 的△H是
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
(10 分)已知甲酸铜遇水易水解而具有还原性。实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:

回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称) 中;制备 Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是 。
(2)写出用小苏打、胆矾制备 Cu2(OH)2CO3的离子方程式 ;实际操作中的小苏打与胆矾 的物质的量之比大于 2∶1,原因是 。
(3)操作a 的名称是 。
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是 。
(5)实验中用无水乙醇洗涤产物的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:填空题
对氮及其化合物的研究具有重要意义。
(1)在1 L密闭容器中,4 mol氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式为_____________,这段时间内v(H2)=_________。
(2)298K时.在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)
N2O4(g)  =-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
=-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。

①298K时,该反应的化学平衡常数为_________(精确到0.01);
②下列情况不是处于平衡状态的是__________(填字母序号);
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时v正____v逆(填“>”、“<”或“=”)。
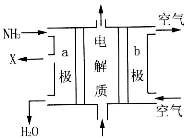
(3)用氨气可设计成如图所示燃料电池,产生的X气体可直接排放到大气中。则a电极电极反应式为________________。
(4)t℃下,某研究人员测定NH3·H2O的电离常数为1.8×10-5。NH4+的水解常数为1.5×10-8,则该温度下水的离子积常数为___________,请判断t_____25℃(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
已知常温下CH3COOH的电离平衡常数为Ka ,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是

A. a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol·L-1
B. b点表示的溶液c(CH3COO-)< c(Na+)
C. b、d点表示的溶液中 相等
相等
D. c点表示CH3COOH和NaOH恰好反应完全
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列化学实验事实及其解释都正确的是
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明同温度下AgCl的Ksp比AgI的Ksp 大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:填空题
(16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。

(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 明矾水解时产生具有吸附性的胶体粒子 | 明矾可作自来水消毒 |
B | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板 中的铜 |
C | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
D | SO2具有氧化性 | SO2可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:填空题
(13分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6 kJ/mol ;
2SO3(g) ΔH=—196.6 kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________。
SO3(g)+NO(g) ΔH 的ΔH=________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:填空题
(6分)
某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
①该溶液中一定存在的离子有______________,一定不存在的离子_____________。
②用一个离子方程式表示操作②的实验现象:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com