
��Ӧ�����Ժ��������ȡ�����Ҫ��Ӧ����Ӧ������������ʯ����ȡ�����Ҫ��Ӧ����2NaI��MnO2��3H2SO4=2NaHSO4��MnSO4��2H2O��I2����2NaIO3��5NaHSO3=2Na2SO4��3NaHSO4��H2O��I2����֪NaIO3����������MnO2����������й�˵����ȷ���� (����)��
| A��I2�ڷ�Ӧ�����ǻ�ԭ����ڷ�Ӧ�������������� |
| B��������Ӧ�����ɵ�����I2ʱת�Ƶĵ�������� |
| C��NaI��NaIO3��һ���������ܷ�Ӧ����I2 |
| D��NaIO3�ڻ�ѧ��Ӧ��ֻ������������������ԭ�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���з�Ӧ��ת�Ƶ��ӵ����ʵ���������2 mol����
| A��1 mol Al�뺬1mol H2SO4��ϡ������Һ��Ӧ |
| B��1mol Cu�뺬4mol HNO3��ϡ������Һ��Ӧ |
| C��1 mol MnO2�뺬2 mol H2O2��˫��ˮ��Ӧ |
| D��1 mol Cu�뺬2 mol H2SO4��Ũ���Ṳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪KClO3��ŨHCI��Ӧ�Ļ�ѧ����ʽΪ��KClO3+6HCl=KCl+3C12+3H2O������K35C1O3��H37Cl���ã�������˵����ȷ���� ( ��
| A��������������Է�������ԼΪ71 |
| B��KCl��ֻ��35C1 |
| C�����õ�KCl�мȺ�35C1�ֺ�37Cl |
| D���������ͱ���ԭ����ԭ����֮��Ϊ5��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ѧ����ʽ�ɼ���������Ԫ�ؼ��仯��������ʡ���֪��
������ԭ��Ӧ��
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl�� 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2�� + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI�� 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
���ֽⷴӦ��
2HSCN + K2CO3 =" 2KSCN" + CO2 �� + H2O�� KCN + CO2 + H2O =" HCN" + KHCO3
�ȷֽⷴӦ��
4NaClO  3NaCl + NaClO4��NaClO4
3NaCl + NaClO4��NaClO4 NaCl + 2O2��
NaCl + 2O2��
����˵������ȷ�ǣ�
| A��������(������Һ)��FeCl3��Co(OH)3��I2 |
| B����ԭ��(������Һ)��Fe(OH)2��I2��KIO3 |
| C�����ȶ��ԣ�NaCl��NaClO4��NaClO |
| D������(ˮ��Һ)��HSCN��H2CO3��HCN |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
O3����ǿ�����ԣ���O3ͨ��KI��Һ�з�����Ӧ��O3��I����H���D��I2��O2��H2O(δ��ƽ)������˵����ȷ���� (����)��
| A����ƽ������ӷ���ʽΪ2O3��2I����4H��=I2��2O2��2H2O |
| B��ÿ����1 mol I2ת�Ƶ���2 mol |
| C��O2�ǻ�ԭ����֮һ |
| D���÷�Ӧ��˵��O2�������Դ���I2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪OCN����ÿ��Ԫ�ض�����8�����ȶ��ṹ���ڷ�ӦOCN����OH����Cl2�D��CO2��N2��Cl����H2O(δ��ƽ)�У������6 mol Cl2��ȫ��Ӧ����������OCN�������ʵ����� (����)��
| A��2 mol | B��3 mol | C��4 mol | D��6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ����������ͨ��30 mLŨ��Ϊ10.00 mol��L��1����������Ũ��Һ�У���������ʱ�����Һ���γ�NaCl��NaClO��NaClO3������ϵ�������ж���ȷ���ǣ� ��
| A����NaOH��Ӧ������һ��Ϊ0.3 mol |
| B��n(Na��)��n(Cl��)����Ϊ7��3 |
| C������Ӧ��ת�Ƶĵ���Ϊn mol����0.15��n��0.25 |
| D��n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ11��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
Ǧ��ұ�����¹������£�
�ٸ���������Ǧ��(PbS)���и�ѡ���ڱ��գ�2PbS��3O2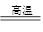 2PbO��2SO2�����ƴ�Ǧ��PbO��C
2PbO��2SO2�����ƴ�Ǧ��PbO��C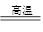 Pb��CO����PbO��CO
Pb��CO����PbO��CO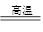 Pb��CO2��
Pb��CO2��
����˵����ȷ����(����)
| A����ѡ��������Ǧ��Ĺ������ڻ�ѧ�仯 |
| B����Ǧ���շ�Ӧ�У�PbS�ǻ�ԭ������ԭ����ֻ��PbO |
| C������ұ�������У���ȡ1 mol Pb��ת��2 mol���� |
| D����l mol PbS��ȫұ����Pb������������Ҫ6 g̼ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com