
【题目】钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A. ![]() Pd和
Pd和 ![]() Pd互为同位素 B. Pd核外有46个电子
Pd互为同位素 B. Pd核外有46个电子
C. Pd核内有46个质子 D. ![]() Pd的原子核内有46个中子
Pd的原子核内有46个中子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )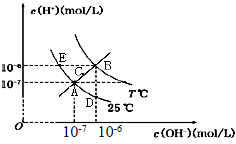
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.决定化学反应速率的主要因素是参加反应的物质的性质
B.催化剂可以使不起反应的物质发生反应
C.可以找到一种催化剂使水变成油
D.催化剂是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数:X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A,B,C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=______。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有____。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com