
[化学—选修5:有机化学基础](15分)
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ.RCOOR′+ R′′18OH  RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
Ⅱ. (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式 。
(1)加成反应(1分)
(2) (2分)
(2分)
(3)碳碳双键(1分) 酯基(1分)
(4) (2分)
(2分)
(5) (2分) (6)a、c (少选1分,错选0分)(2分)
(2分) (6)a、c (少选1分,错选0分)(2分)
(7) (2分)
(2分)
(8)

(2分)
【解析】
试题分析::根据合成路线可知:(1)①为乙烯与溴的加成反应生成A为1,2-二溴已烷;(2)②为1,2-二溴已烷在氢氧化钠水溶液中的水解反应生成乙二醇。化学方程式为 ;(3)P由反应⑧可知PMMA为烯酯类加聚反应产物。故其单体的官能团名称是碳碳双键和酯基。(4)F为醇催化氧化生成,其核磁共振氢谱显示只有一组峰结构对称,故⑤的化学方程式为
;(3)P由反应⑧可知PMMA为烯酯类加聚反应产物。故其单体的官能团名称是碳碳双键和酯基。(4)F为醇催化氧化生成,其核磁共振氢谱显示只有一组峰结构对称,故⑤的化学方程式为 (5)G由丙酮在i:HCN/OH-,ii: H2O/H+作用下生成,由题目信息可知其结构简式为
(5)G由丙酮在i:HCN/OH-,ii: H2O/H+作用下生成,由题目信息可知其结构简式为 ;(6)a.⑦为由
;(6)a.⑦为由 与甲醇酯化反应生成PMMA单体,故a正确。b.B为乙二醇,D为甲醇,二者不是同系物,故b错误。 c.D为甲醇分子间可产生氢键,所以其沸点比同碳原子数的烷烃高,故c正确。d.1 mol
与甲醇酯化反应生成PMMA单体,故a正确。b.B为乙二醇,D为甲醇,二者不是同系物,故b错误。 c.D为甲醇分子间可产生氢键,所以其沸点比同碳原子数的烷烃高,故c正确。d.1 mol  中含2mol酯基,所以与足量NaOH溶液反应时,最多消耗2 mol NaOH,故d错误。答案选c。
中含2mol酯基,所以与足量NaOH溶液反应时,最多消耗2 mol NaOH,故d错误。答案选c。
(7)J为2-甲基丙烯酸,其同分异构体中具有碳碳双键与羧基,且为顺式结构,其结构简式是 。(8)经分析可知制备PET聚酯的化学方程式为:
。(8)经分析可知制备PET聚酯的化学方程式为: 。
。
考点:了解有机物分子中的官能团及其性质,能正确地表示它们的结构,能判断简单有机化合物的同分异构体,了解加成反应、取代反应和消去反应,了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体。


科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
在523K时,有以下反应:2HCl(g)+ CrO3(g) CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
A.加热 B.使用催化剂 C.加压 D.分离出水气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列实验对应的结论不正确的是


A.①能组成Zn-Cu原电池
B.②能证明非金属性Cl>C>Si
C.③能说明 △H<0
△H<0
D.④中自色沉淀为BaS04
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g
nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g cm-3。
cm-3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH- Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.每制得1mol Na2FeO4,理论上可以产生67.2L气体
D.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:实验题
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实解释错误的是
选项 | 现象或事实 | 解释 |
A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
B | SO2能使品红溶液褪色 | SO2具有漂白性 |
C | “地沟油”禁止食用,但可以用来制肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
化合物III可通过如下反应制得:

化合物I可通过下列路径合成:

(1)化合物I的分子式为 。化合物Ⅱ中含氧官能团的名称 。
(2)化合物III与NaOH溶液共热反应的方程式为 。
(3)化合物IV的结构简式为 ,生成化合物IV的反应类型为 。
(4)化合物I能发生消去反应,其中一种有机产物的结构简式 。
(5)一定条件下,1 mol化合物Ⅱ和H2反应,最多可消耗H2 mol。
(6)CH3CH2MgBr和 也能发生类似V→VI 的反应,其化学反应方程式 。
也能发生类似V→VI 的反应,其化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
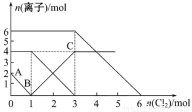
A.离子的还原性顺序为:Fe2+>I->Br-
B.原混合溶液中FeBr2的物质的量为4mol
C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com