
【题目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉, 最多能溶解 l9.2g(已知硝酸只被还原为 NO 气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法不正确的是( )

A. c 点时,溶液中的溶质为 FeSO4
B. oa 段发生反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
C. 原混和酸中稀硝酸的物质的量浓度为 2mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4mol/L
【答案】B
【解析】
由图象可知,由于铁过量,硝酸和硫酸氧化性不同,反应分阶段进行,氧化性强的物质先反应,则oa段铁与稀硫酸和稀硝酸的混合溶液反应生成硫酸铁、一氧化氮和水,发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,ab段硫酸铁与铁反应生成硫酸亚铁,发生反应为:Fe+2Fe3+=3Fe2+,bc段铁与稀硫酸反应生成硫酸亚铁和氢气,发生反应为:Fe+2H+=Fe2++H2↑。
A项、由图象可知,混合溶液中硝酸全部被还原生成一氧化氮,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故A正确;
B项、oa段铁与稀硫酸和稀硝酸的混合溶液反应生成硫酸铁、一氧化氮和水,反应的化学方程式为:2Fe+3H2SO4+2HNO3=Fe2(SO4)3+2NO↑+4H2O,故B错误;
C项、有图像可知,oa段反应的铁的物质的量n(Fe)为0.2mol,由方程式Fe+NO3-+4H+=Fe3++NO↑+2H2O可知,n(Fe)= n(NO3-)=0.2mol,则100ml溶液中稀硝酸的物质的量浓度为 2mol/L,故C正确;
D项、c点加入22.4g铁,铁与稀硫酸和稀硝酸恰好完全反应生成硫酸亚铁,溶液中亚铁离子的物质的量为0.4mol,由电荷守恒可知,硫酸根的物质的量为0.4mol,则100ml溶液中稀硫酸的物质的量浓度为4mol/L,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】溶液中滴入氢氧化钠溶液后。先产生白色沉淀,然后变为灰绿色,最后变为红褐色,说明该溶液中存在( )
A.NO3-B.Fe2+C.SO42-D.Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制Si。制取过程中不涉及到的化学反应是
A. SiO2+2C![]() Si+2CO
Si+2CO
B. SiO2+2NaOH=Na2SiO3
C. Si+2Cl2![]() SiCl4
SiCl4
D. SiCl4+2H2![]() Si+4HCl
Si+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中Al3+的浓度(mol/L)为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应设计了图示实验装置。

(1)在装药品开始实验前要进行的操作是_____
(2)a 克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A 无明显现象,其原因是常温下①_____;②_____。
(3)写出加热时 A 中碳与浓硫酸发生反应的化学方程式_____。
(4)B 中的现象是:_____;C 的作用是:_____。
(5)待 A 中不再逸出气体时,停止加热,拆下 E 并称重,E 增重 bg。则铁碳合金中铁的质量分数为_____(写含 a、b 的表达式)。
(6)经测定,(5)中测得结果偏小,原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
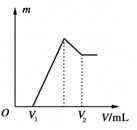
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
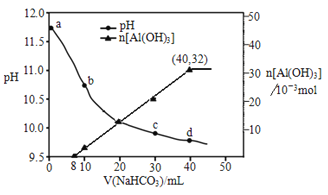
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com