
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。

【答案】加快化学反应速率,提高镍的浸出率 NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O 2Fe2++H2O2+2H+═2Fe3++2H2O 5.0≤pH<6.7 CaF2 31.8 70 120
【解析】
含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)将含镍原料粉碎可以加快化学反应速率,提高镍的浸出率;
(2)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
(5)由流程以及物质的溶解性分析可知,滤渣3为CaF2;
(6)已知NiCO3的Ksp=1.0×10-5,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol·L-1],则溶液中c(CO32-)=Ksp/c(Ni2+)=1.0×10-5/10-5mol·L-1=1.0mol·L-1,与Ni2+反应的n(CO32-)=cV=2mol·L-1×0.1L=0.2mol,则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+1.0mol·L-1×0.1L=0.3mol,所以m=n![]() M=0.3mol×106g·mol-1=31.8g;
M=0.3mol×106g·mol-1=31.8g;
(7)由图象可知,为70℃、120min时,酸浸出率最高;


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。

下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别为

A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表示方法中错误的是
A. 次氯酸的电子式: ![]()
B. M2+离子核外有 a个电子,b个中子,M 原子符号为a+b+2a+2M
C. 用电子式表示MgCl2 的形成过程为 ![]()
D. Na+的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可成甘油、医药、农药香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ键,烯丙醇分子中碳原子的杂化类型为_____________。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________,与SCN-互为等电子体的分子为____________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉, 最多能溶解 l9.2g(已知硝酸只被还原为 NO 气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法不正确的是( )

A. c 点时,溶液中的溶质为 FeSO4
B. oa 段发生反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
C. 原混和酸中稀硝酸的物质的量浓度为 2mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)
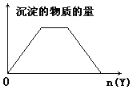
A. 向含NaOH的NaAlO2溶液中滴加盐酸
B. 向HCl和AlCl3的混合液中滴加NaOH
C. 向NH4Cl和AlCl3的混合液中滴加NaOH
D. 向NaOH和Ca(OH)2的混合液中通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式不正确的是
A. 纯碱溶液遇酚酞变红:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O ![]() Cl2↑+H2↑+20H-
Cl2↑+H2↑+20H-
C. 纯碱溶液处理锅炉中的水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D. 在Fe(NO3)2溶液中加稀硫酸有气体产生:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com