
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。

下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
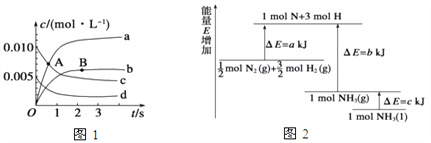
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为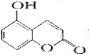 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(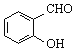 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中滴入氢氧化钠溶液后。先产生白色沉淀,然后变为灰绿色,最后变为红褐色,说明该溶液中存在( )
A.NO3-B.Fe2+C.SO42-D.Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______________、_________________。
(2)操作I为__________________操作Ⅱ为______________
(3)方案I中如何判别加入的氯化钡已经过量______________________________
(4)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(5) 在方案Ⅱ中发生的离子反应方程式为__________________________
(6)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(7)有同学模仿方案I,提出方案Ⅲ:取50.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a.方案I比方案Ⅲ的计算结果要低
b.方案I比方案Ⅲ的计算结果要高
c.m1=m2 ,方案I和方案Ⅲ的结果一样
d.方案Ⅲ不应根据方案I的方法计算
(8)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-下列说法正确的是( )
A. 气体乙和气体丙都为纯净物
B. 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 ,可能含有NaHCO3、Na2CO3
C. 溶液丁中的阳离子一定只含H+、Fe2+
D. 溶液甲中一定含有AlO2- ,可能含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com