
ЁОЬтФПЁПЮЊСЫВтЖЈЪЕбщЪвГЄЦкДцЗХЕФNa2SO3ЙЬЬхЕФДПЖШЃЌзМШЗГЦШЁM gЙЬЬхбљЦЗЃЌХфГЩ250 mLШмвКЁЃЩшМЦСЫвдЯТСНжжЪЕбщЗНАИЃК
ЗНАИIЃКШЁ50.00 mLЩЯЪіШмвКЁњМгШызуСПЕФбЮЫсЫсЛЏЕФBaCl2ШмвКЁњВйзїIЁњЯДЕгЁњВйзїЂђЁњГЦСПЃЌЕУЕНГСЕэЕФжЪСПЮЊm1 g
ЗНАИЂђЃКШЁ50.00 mLЩЯЪіШмвКЃЌгУa mol/L ЕФЫсадKMnO4ШмвКНјааЕЮЖЈЁЃ
ЪЕбщжаЫљМЧТМЕФЪ§ОнШчЯТБэЃК
ЕЮЖЈДЮЪ§ ЪЕбщЪ§Он | 1 | 2 | 3 | 4 |
Д§ВтШмвКЬхЛ§/mL | 50.00 | 50.00 | 50.00 | 50.00 |
ЕЮЖЈЙмГѕЖСЪ§/mL | 0.00 | 0.20 | 0.10 | 0.15 |
ЕЮЖЈЙмФЉЖСЪ§/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)ХфжЦ250 mL Na2SO3ШмвКЪБЃЌБиаыгУЕНЕФЪЕбщвЧЦїгаЃКЩеБЁЂВЃАєЁЂЕЮЙмЁЂвЉГзКЭ_______________ЁЂ_________________ЁЃ
(2)ВйзїIЮЊ__________________ВйзїЂђЮЊ______________
(3)ЗНАИIжаШчКЮХаБ№МгШыЕФТШЛЏБЕвбОЙ§СП______________________________
(4)дкЗНАИЂђжаЕЮЖЈжеЕуЕФХаЖЯЗНЗЈЪЧ_______________________________ЁЃ
(5) дкЗНАИЂђжаЗЂЩњЕФРызгЗДгІЗНГЬЪНЮЊ__________________________
(6)ИљОнЗНАИЂђЫљЬсЙЉЕФЪ§ОнЃЌМЦЫуNa2SO3ЕФДПЖШЮЊ___________ЁЃЃЈаДГЩЗжЪ§аЮЪНЃЉ
(7)гаЭЌбЇФЃЗТЗНАИIЃЌЬсГіЗНАИЂѓЃКШЁ50.00 mLЩЯЪіШмвКЁњМгШызуСПЕФбЮЫсЫсЛЏЕФBa(NO3)2ШмвКЁњВйзїIЁњЯДЕгЁњВйзїЂђЁњГЦжиЃЌЕУЕНГСЕэжЪСПЮЊm2 g ВЂгУЗНАИIЕФЗНЗЈМЦЫуНсЙћЁЃ
ИљОнЗНАИЂѓЃЌДгРэТлЩЯНВЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ________ЃЈЬюађКХЃЉ
aЃЎЗНАИIБШЗНАИЂѓЕФМЦЫуНсЙћвЊЕЭ
bЃЎЗНАИIБШЗНАИЂѓЕФМЦЫуНсЙћвЊИп
cЃЎm1=m2 ЃЌЗНАИIКЭЗНАИЂѓЕФНсЙћвЛбљ
dЃЎЗНАИЂѓВЛгІИљОнЗНАИIЕФЗНЗЈМЦЫу
(8)ЩЯЪіЪЕбщжаЃЌгЩгкВйзїДэЮѓЫљв§Ц№ЕФЪЕбщЮѓВюЗжЮіе§ШЗЕФЪЧ__________ЃЈЬюађКХЃЉЁЃ
aЃЎЗНАИIжаШчЙћУЛгаЯДЕгВйзїЃЌЪЕбщНсЙћНЋЦЋаЁ
bЃЎЗНАИIжаШчЙћУЛгаВйзїЂђЃЌЪЕбщНсЙћНЋЦЋДѓ
cЃЎЗНАИЂѓжаШчЙћУЛгаЯДЕгВйзїЃЌЪЕбщНсЙћНЋЦЋаЁ
dЃЎЗНАИЂѓжаШчЙћУЛгаВйзїЂђЃЌЪЕбщНсЙћНЋЦЋДѓ
ЁОД№АИЁПЬьЦН250mLЕФШнСПЦПЙ§ТЫИЩдяЃЈКцИЩЃЉОВжУЗжВуКѓЃЌЯђЩЯЧхвКжаМгШыбЮЫсЫсЛЏЕФТШЛЏБЕЃЌВЛдйВњЩњГСЕэЃЌМДвбГСЕэЭъШЋМгШызюКѓвЛЕЮИпУЬЫсМиШмвККѓШмвКгЩЮоЩЋБфЮЊзЯЩЋЃЌЧвдкАыЗжжгФкВЛЭЪ2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O1323a/40Mbdad
ЁОНтЮіЁП
(1)ХфжЦ250 mL Na2SO3ШмвКЕФЙ§ГЬЮЊЃКзМШЗГЦШЁM gЙЬЬхбљЦЗашвЊЬьЦН,ШмНташвЊдкЩеБжагУВЃСЇАєНСАш,биВЃСЇАєзЊвЦЕН250 mLШнСПЦП,МгЫЎЕНРы2~3cmДІИФгУНКЭЗЕЮЙмЖЈШнЕНПЬЖШХфГЩ250 mLШмвК,ХфжЦ250 mL Na2SO3ШмвКЪБ,БиаыгУЕНЕФЪЕбщвЧЦїга:ЩеБЁЂВЃАєЁЂЕЮЙмЁЂвЉГзКЭЕчзгЬьЦНЁЂ250 mLЕФШнСПЦП,
(2)ШЁ2.500 mLЩЯЪіШмвК,МгШызуСПЕФбЮЫсЫсЛЏЕФBaCl2ШмвКЩњГЩСђЫсБЕГСЕэ![]() Й§ТЫ
Й§ТЫ![]() ЯДЕг
ЯДЕг![]() ИЩдя
ИЩдя![]() ГЦСП,ЕУЕНГСЕэЕФжЪСПЮЊm1g,ВйзїIЮЊЗжРыЙЬЬхКЭвКЬхгУЙ§ТЫ,ВйзїЂђЮЊИЩдяГСЕэ;
ГЦСП,ЕУЕНГСЕэЕФжЪСПЮЊm1g,ВйзїIЮЊЗжРыЙЬЬхКЭвКЬхгУЙ§ТЫ,ВйзїЂђЮЊИЩдяГСЕэ;
(3)ХаБ№МгШыЕФТШЛЏБЕвбОЙ§СПЕФЗНЗЈЮЊ:ОВжУЗжВуКѓ,ЯђЩЯЧхвКжаМгШыбЮЫсЫсЛЏЕФТШЛЏБЕ,ВЛдйВњЩњГСЕэ,МДвбГСЕэЭъШЋ;
(4)дкЗНАИЂђжаЕЮЖЈжеЕуЕФХаЖЯЗНЗЈЪЧМгШызюКѓвЛЕЮКѓШмвКгЩЮоЩЋБфЮЊзЯЩЋ,ЧвдкАыЗжжгФкВЛЭЪ;
(5)ЫсадKMnO4ОпгабѕЛЏадЃЌSO32-ОпгаЛЙдадЃЌСНепЗЂЩњбѕЛЏЛЙдЗДгІЃЌРызгЗДгІЗНГЬЪНЮЊЃК2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2OЃЛ
(6)ДгЭМБэжа4зщЪ§ОнПЩжЊ,ЯћКФЕФИпУЬЫсМиЕФЬхЛ§ЗжБ№ЮЊЃК20.95mLЁЂ21.00mLЁЂ20.05mLЁЂ21.05mLЃЌЕкШ§зщЪ§ОнЮѓВюНЯДѓ,гІЩсШЅ, ИпУЬЫсМиЦНОљЯћКФЕФШмвКЬхЛ§V=(20.95mL+21.00mL+21.05mL)/3=21.00mL,ЯћКФИпУЬЫсМиЕФЮяжЪЕФСПЮЊa mol/LЁС0.021L=0.021amolНсКЯЛЏбЇЗНГЬЪНЖЈСПЙиЯЕМЦЫу, 2MnO4-~5SO32-ПЩжЊЃЌ50.00 mLЕФЩЯЪіШмвКжаКЌгабЧСђЫсФЦЕФЮяжЪЕФСПЮЊ0.021amolЁС5/2=21a/400mol,дђMgЙЬЬхжабЧСђЫсФЦЕФЮяжЪЕФСПЮЊ21a/400molЁС250mL/50mL=21a/80mol,ЫљвдбЧСђЫсФЦЕФДПЖШЮЊЃК21a/80molЁС126g/molЁТMgЁС100%=1323a/40M;
(7)ЗНАИIШчВйзїЙ§ГЬНЯТ§,ПЩЕМжТВПЗжбЧСђЫсБЛбѕЛЏЮЊСђЫс,НјЖјЩњГЩВЛШмгкбЮЫсЕФСђЫсБЕГСЕэ,ЕМжТНсЙћЦЋДѓ,ЗНАИЂѓЩњГЩЕФСђЫсБЕГСЕэРДдДгкбљЦЗжаКЌгаЕФСђЫсФЦКЭбЧСђЫсФЦ,ЦфжабЧСђЫсФЦБЛбѕЛЏЩњГЩСђЫсФЦ,ЩњГЩЕФСђЫсБЕГСЕэЕФжЪСПНЯДѓ, ЗНАИIМЦЫуСђЫсБЕЕФжЪСППЩШЗЖЈСђЫсФЦЕФжЪСП,НјЖјМЦЫубЧСђЫсФЦЕФДПЖШ,ЖјЗНАИЂѓИљОнСђЫсБЕЕФжЪСППЩШЗЖЈСђЫсФЦЁЂбЧСђЫсФЦЕФЮяжЪЕФСПзмСП,НсКЯЖўепжЪСППЩШЗЖЈбЧСђЫсФЦЕФжЪСП,СНжжЗНАИВЛЭЌ,МЦЫуЗНЗЈВЛЭЌЁЃ
вђДЫЃЌБОЬте§ШЗД№АИЪЧ:bd;
(6)a.ЗНАИIжаШчЙћУЛгаЯДЕгВйзї,ВтЕУЩњГЩСђЫсИљБЕжЪСПдіДѓ,дђбЧСђЫсФЦЕФжЪСПЦЋаЁ,ЙЪaе§ШЗ;
b.ЗНАИIжаШчЙћУЛгаВйзїЂђ,ВтЕУЩњГЩСђЫсБЕжЪСПдіДѓ,дђбЧСђЫсФЦЕФжЪСПЦЋаЁ,ЙЪbДэЮѓ;
c.ЗНАИЂѓжаШчЙћУЛгаЯДЕгВйзї,ВтЕУЩњГЩСђЫсБЕжЪСПдіДѓ,дђВтЖЈНсЙћЦЋДѓ,ЙЪcДэЮѓ;
d.ЗНАИЂѓжаШчЙћУЛгаВйзїЂђ,ВтЕУЩњГЩСђЫсБЕжЪСПдіДѓ,БЛбѕЛЏЕФбЧСђЫсФЦжЪСПдіДѓ,ВтЖЈНсЙћЦЋДѓ,ЙЪdе§ШЗ.
вђДЫЃЌБОЬте§ШЗД№АИЪЧ:ad.


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2010ФъХЕБДЖћЮяРэбЇНБЫљжИЯђЕФЪЧЬМЕФгжвЛеХЦцУюСГПзЃКШЫРрвбжЊЕФзюБЁВФСЯЁЊЁЊЪЏФЋЯЉЁЃЯТСаЫЕЗЈжаЃЌе§ШЗЕФЪЧ ЃЈ ЃЉ

A. ЙЬЬЌЪБЃЌЬМЕФИїжжЕЅжЪЕФОЇЬхРраЭЯрЭЌ
B. ЪЏФЋЯЉКЌгаМЋадМќ
C. ДгЪЏФЋАўРыЕУЪЏФЋЯЉашвЊЦЦЛЕЛЏбЇМќ
D. ЪЏФЋЯЉОпгаЕМЕчад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЬМЁЂЕЊКЭТСЕФЕЅжЪМАЦфЛЏКЯЮядкЙЄХЉвЕЩњВњКЭЩњЛюжагаживЊзїгУЁЃецПеЬМШШЛЙдвЛТШЛЏЗЈПЩЪЕЯжгЩТСПѓжЦБИН№ЪєТСЃЌЦфЯрЙиЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
2Al2O3ЃЈsЃЉ+ 2AlCl3ЃЈgЃЉ+ 6CЃЈsЃЉЃН6AlClЃЈgЃЉ+ 6COЃЈgЃЉЃЛЁїHЃН a kJmol-1
3AlClЃЈgЃЉЃН 2AlЃЈlЃЉ+ AlCl3ЃЈgЃЉЃЛЁїHЃН b kJmol-1
ЗДгІAl2O3ЃЈsЃЉ+ 3CЃЈsЃЉЃН 2AlЃЈlЃЉ+ 3COЃЈgЃЉЕФЁїHЃН______ kJmol-1ЃЈгУКЌaЁЂbЕФДњЪ§ЪНБэЪОЃЉЁЃ
ЃЈ2ЃЉ830KЪБЃЌдкУмБеШнЦїжаЗЂЩњЯТСаПЩФцЗДгІЃКCOЃЈgЃЉ+H2OЃЈgЃЉCO2ЃЈgЃЉ+H2ЃЈgЃЉЁїHЃМ0ЃЌЪдЛиД№ЯТСаЮЪЬтЃК
ЂйШєЦ№ЪМЪБcЃЈCOЃЉ=2molLЉ1ЃЌcЃЈH2OЃЉ=3molLЉ1ЃЌДяЕНЦНКтЪБCOЕФзЊЛЏТЪЮЊ60%ЃЌдђдкИУЮТЖШЯТЃЌИУЗДгІЕФЦНКтГЃЪ§K=__ЃЎ
ЂкдкЯрЭЌЮТЖШЯТЃЌШєЦ№ЪМЪБcЃЈCOЃЉ=1molLЉ1ЃЌcЃЈH2OЃЉ=2molLЉ1ЃЌЗДгІНјаавЛЖЮЪБМфКѓЃЌВтЕУH2ЕФХЈЖШЮЊ0.5molLЉ1ЃЌдђДЫЪБИУЗДгІЪЧЗёДяЕНЦНКтзДЬЌ__ЃЈЬюЁАЪЧЁБгыЁАЗёЁБЃЉЃЌДЫЪБvЃЈе§ЃЉ__vЃЈФцЃЉЃЈЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЃЌФуХаЖЯЕФвРОнЪЧ____________________
ЂлШєНЕЕЭЮТЖШЃЌИУЗДгІЕФKжЕНЋ__ЃЌИУЗДгІЕФЛЏбЇЗДгІЫйТЪНЋ__ЃЈОљЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊФГРызгОЇЬхЕФОЇАћЪОвтЭМШчЯТЭМЫљЪО,ЦфФІЖћжЪСПЮЊM gЁЄmol-1,АЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNA,ОЇЬхЕФУмЖШЮЊd gЁЄcm-3ЁЃ

ЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A. ОЇЬхОЇАћжавѕЁЂбєРызгЕФИіЪ§ЖМЮЊ1
B. ОЇЬхжавѕЁЂбєРызгЕФХфЮЛЪ§ЖМЪЧ4
C. ИУОЇАћПЩФмЪЧNaClЕФОЇАћ
D. ИУОЇЬхжаСНИіОрРызюНќЕФбєРызгЕФКЫМфОрЮЊM/d cm
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЊЛЦЫигаПЙбѕЛЏЁЂБЃИЮЛЄИЮЁЂвжжЦжзСіЩњГЄЕШЙІФмЁЃЫќЕФНсЙЙМђЪНШчЭМЫљЪО

вбжЊЃК
ЯТСагаЙиНЊЛЦЫиЕФЫЕЗЈе§ШЗЕФЪЧ
A. НЊЛЦЫидквЛЖЈЬѕМўЯТФмЗЂЩњЫЎНтЁЂМгГЩЁЂбѕЛЏЗДгІ
B. 1ИіНЊЛЦЫиЗжзгвЛЖЈга15ИідзгЙВЦНУц
C. 1molНЊЛЦЫидкФјЃЈNiЃЉЁЂМгШШЬѕМўЯТзюЖр10molH2ЗЂЩњМгГЩЗДгІ
D. НЊЛЦЫиЕФЗжзгЪНЮЊC21H18O6
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжаЃЌвРДЮЪєгкЕЅжЪЁЂЫсЁЂбЮЕФвЛзщЪЧЃЈЁЁЁЁЃЉ
A.ИЩБљЁЂЪЏЛвЪЏЁЂбѕЛЏИЦ
B.бѕЦјЁЂСђЫсЁЂЪьЪЏЛв
C.ЫЎЁЂЩеМюЁЂЪГбЮ
D.вКТШЁЂЯѕЫсЁЂДПМю
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкNa2O2ЕФа№ЪіВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
AЃЎ1 mol Na2O2гызуСПCO2ЗДгІзЊвЦЕФЕчзгЮЊ1 mol
BЃЎНЋ10 g H2КЭCOЕФЛьКЯЦјЬхГфЗжШМЩеЃЌНЋЩњГЩЮя(H2OЁЂCO2)ЭЈШызуСПЕФNa2O2ЙЬЬхжаГфЗжЗДгІЃЌЙЬЬхдіжиЮЊ10 g
CЃЎНЋNa2O2ЭЖШыFeSO4ШмвКжаЩњГЩКьКжЩЋГСЕэ
DЃЎНЋЕШЮяжЪЕФСПЕФNaHCO3КЭNa2O2ЛьКЯКѓЃЌдкУмБеШнЦїжаГфЗжМгШШХХГ§ЦјЬхКѓЪЃгрЙЬЬхЮЊNa2CO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋNa2O2ж№НЅМгШыЕНКЌгаH+ЁЂMg2+ЁЂAl3+ЁЂNH4+ЕФЛьКЯвКжаВЂЮЂШШЃЌВњЩњГСЕэКЭЦјЬхЕФЮяжЪЕФСПЃЈmolЃЉгыМгШыЕФNa2O2ЮяжЪЕФСПЃЈmolЃЉЕФЙиЯЕШчЭМЫљЪОЃЌдђдШмвКжаЕФMg2+ЁЂAl3+ЁЂNH4+ЮяжЪЕФСПЗжБ№ЮЊ

A. 2 molЁЂ3 molЁЂ6 mol B. 3 molЁЂ2 molЁЂ6mol
C. 2 molЁЂ3 molЁЂ4 mol D. 3 molЁЂ2 molЁЂ2 mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђXЕФШмвКжаЃЌМгШыYЪдМСЃЌВњЩњЕФГСЕэЪОвтЭМШчЭМЫљЪОЧщаЮЕФЪЧ(зЂвтЯпЖЮЕФаБТЪ)
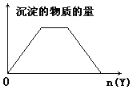
A. ЯђКЌNaOHЕФNaAlO2ШмвКжаЕЮМгбЮЫс
B. ЯђHClКЭAlCl3ЕФЛьКЯвКжаЕЮМгNaOH
C. ЯђNH4ClКЭAlCl3ЕФЛьКЯвКжаЕЮМгNaOH
D. ЯђNaOHКЭCa(OH)2ЕФЛьКЯвКжаЭЈШыCO2
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com