
【题目】下列关于Na2O2的叙述不正确的是( )
A.1 mol Na2O2与足量CO2反应转移的电子为1 mol
B.将10 g H2和CO的混合气体充分燃烧,将生成物(H2O、CO2)通入足量的Na2O2固体中充分反应,固体增重为10 g
C.将Na2O2投入FeSO4溶液中生成红褐色沉淀
D.将等物质的量的NaHCO3和Na2O2混合后,在密闭容器中充分加热排除气体后剩余固体为Na2CO3
【答案】D
【解析】
试题过氧化钠与水的反应中,既是氧化剂,也是还原剂,1 mol Na2O2与足量CO2反应转移的电子为1 mol,A正确;氢气和CO燃烧生成水和CO2,生成的水和CO2又和过氧化钠反应生成氧气,所以固体增加的质量就是氢气和CO的质量,B正确;过氧化钠具有强氧化性,能把硫酸亚铁氧化生成硫酸铁,进而生成氢氧化铁红褐色沉淀,C正确;NaHCO3与Na2O2混合,在密闭容器中充分加热,碳酸氢钠固体加热反应方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O,所产生的气体CO2、H2O分别与Na2O2的反应,方程式是2CO2+2Na2O2=2Na2CO3+O2↑,2H2O+2Na2O2=4NaOH+O2↑。由于NaHCO3和Na2O2的物质的量相等,所以含有后生成物恰好是碳酸钠后氢氧化钠,D不正确,答案选D。
Na2CO3+CO2↑+H2O,所产生的气体CO2、H2O分别与Na2O2的反应,方程式是2CO2+2Na2O2=2Na2CO3+O2↑,2H2O+2Na2O2=4NaOH+O2↑。由于NaHCO3和Na2O2的物质的量相等,所以含有后生成物恰好是碳酸钠后氢氧化钠,D不正确,答案选D。


科目:高中化学 来源: 题型:
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
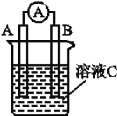
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(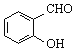 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______________、_________________。
(2)操作I为__________________操作Ⅱ为______________
(3)方案I中如何判别加入的氯化钡已经过量______________________________
(4)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(5) 在方案Ⅱ中发生的离子反应方程式为__________________________
(6)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(7)有同学模仿方案I,提出方案Ⅲ:取50.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a.方案I比方案Ⅲ的计算结果要低
b.方案I比方案Ⅲ的计算结果要高
c.m1=m2 ,方案I和方案Ⅲ的结果一样
d.方案Ⅲ不应根据方案I的方法计算
(8)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前三周期的主族元素,它们的原子序数按A、B、C、D、E的顺序增大。A的最外层电子数是次外层电子数的2倍,C与E最外层电子数相等,E的最高价氧化物中含氧60%,D与C可形成D2C、D2C2两种离子化合物。填写下列空白:
(1)写出上述五种元素的元素符号:A___,B___,C___,D____,E___。
(2)写出D2C2的电子式_________,AC2的结构式___________。
(3)用电子式表示 AC2化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-下列说法正确的是( )
A. 气体乙和气体丙都为纯净物
B. 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 ,可能含有NaHCO3、Na2CO3
C. 溶液丁中的阳离子一定只含H+、Fe2+
D. 溶液甲中一定含有AlO2- ,可能含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是

A. 电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B. 石墨极的电极反应式为2H2O+4e-=4H++O2↑
C. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)上图中元素C在周期表中的位置是___________,G和I形成的化合物不止一种,其中一种物质中各原子最外层均达到8电子稳定结构,请写出其电子式______________。
(2)请按照由大到小的顺序写出B、C、D的简单离子的离子半径大小顺序_______(用离子符号表示),上述元素中最高价氧化物对应的水化物中酸性最强的物质的化学式为___________ 。
(3)请写出D的最高价氧化物对应的水化物和F的单质反应时的离子方程式____________。
(4)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别Be(OH)2和Mg(OH)2可选用的试剂为NaOH溶液,发生反应的化学方程式为___________。
(5)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是___________。
① HCl的稳定性比H2S的强,② Cl2能与H2S反应生成S,③HCl的溶解度比H2S的大,④还原性:Cl-<S2-,⑤HClO4的酸性比H2SO4的强,⑥HCl的酸性比H2S的强,⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物的元素组成的叙述,正确是
A. 蛋白质的元素组成中一定含有氮和硫
B. 脂肪的元素组成中一定含有碳和氮
C. 叶绿素的元素组成中一定含有碳和镁
D. 磷脂的元素组成中一定含有硫和磷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com