
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(夹持装置略,气密性已检验)如图所示。下列推断不合理的是

A. B中收集到的气体是氢气
B. 烧杯中双氧水溶液的作用是将Fe2+ 氧化为Fe3+
C. A中存在氧化铁与盐酸反应生成氯化铁的反应
D. 向反应后的烧杯中通入少量SO2,溶液颜色将立即由棕黄色变为浅绿色
科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全燃烧的产物全部通入到足量的过氧化钠固体中,则过氧化钠固体增重为a g的是( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. ①②⑥ B. ③④⑤ C. ①②④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮藏溶液 ③不能用来加热;④使用之前要检査是否漏水。这些叙述中正确的是
A. ①②③④ B. ②③ C. ①② D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业生产金属铝的原料,铝土矿的主要成分为氧化铝和水,另外还含有杂质Fe2O3、SiO2等,下图是工业冶炼铝的流程:

回答下列问题:
(1)如流程图所示,第一步为溶解过程,即在铝土矿中加入硫酸,发生反应的离子方程式为____。该过程一般选用硫酸,而不选用盐酸,原因是____。
(2)滤渣I的成分是____(写化学式,下同),滤渣II的成分是____。
(3)实际工业操作中,流程图中的试剂a和试剂b必须过量,试剂a为____,试剂b为____,流程图中,“滤液II”的溶质为____。
(4)一次生产中,铝土矿中氧化铝的含量为48.6%,三次过滤操作中铝的损失率均为6.8%,电解过程中的转化率为92%,其他操作过程没有铝的损失,那么2.00 t 铝土矿可冶炼出金属铝__t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用对应关系不正确的是
A.铝有还原性,可冶炼某些金属
B.FeCl3有氧化性,可用于金属的蚀刻
C.亚硫酸钠有还原性,可用作脱氧剂
D.浓硫酸有吸水性,可用于干燥氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于300mL 1molL﹣1盐酸与铁片的反应,其中能使反应速率加快的措施( )
A.升高温度
B.再加300mL 1 molL﹣1盐酸
C.用等量铁片代替铁粉
D.改用100mL 98%的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
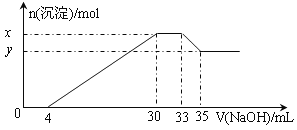
A. X与Y的差值为0.01 mol
B. 原溶液中c(Cl-)=0.66mol·L-1
C. 原溶液的c(H+)=0.8 mol·L-1
D. 原溶液中n(Mg2+)∶n(Al3+)=10∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为A g ②称量装有试样的坩埚质量为B g ③加热④冷却⑤称量坩埚和残余物的质量为C g⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式为 .
(2)计算Na2CO3质量分数必须用到的测定数据为(填“A”、“B”、“C”或“D”).
乙方案:
在天平上准确称取0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mo1L﹣1 , 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3 . 重复上述操作两次,消耗盐酸的体积为20.00mL.
(3)配制上述盐酸标准溶液100mL,若用2.0molL﹣1HCl进行配制,需用滴定管量取该HCl溶液mL;定容时俯视刻度线,将导致配制的溶液浓度(填“偏高”、“偏低”或“没有影响”).
(4)样品中Na2CO3的质量分数为(用百分数表示,精确到0.1%).
丙方案:称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.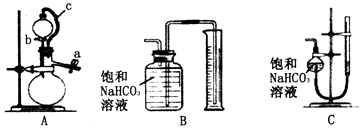
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若装置不漏气,则观察到的现象为 . 实验时,装置A中c的作用、 .
(6)为了提高测定的准确性,应选用装置A和(填写字母标号)进行实验.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com