
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为A g ②称量装有试样的坩埚质量为B g ③加热④冷却⑤称量坩埚和残余物的质量为C g⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式为 .
(2)计算Na2CO3质量分数必须用到的测定数据为(填“A”、“B”、“C”或“D”).
乙方案:
在天平上准确称取0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mo1L﹣1 , 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3 . 重复上述操作两次,消耗盐酸的体积为20.00mL.
(3)配制上述盐酸标准溶液100mL,若用2.0molL﹣1HCl进行配制,需用滴定管量取该HCl溶液mL;定容时俯视刻度线,将导致配制的溶液浓度(填“偏高”、“偏低”或“没有影响”).
(4)样品中Na2CO3的质量分数为(用百分数表示,精确到0.1%).
丙方案:称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.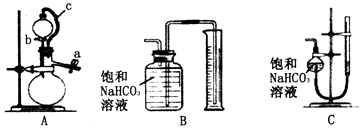
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若装置不漏气,则观察到的现象为 . 实验时,装置A中c的作用、 .
(6)为了提高测定的准确性,应选用装置A和(填写字母标号)进行实验.
【答案】
(1)2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(2)A、B、D
(3)5.00;偏高
(4)70.7%
(5)水流下一段时间后不再流出,且持续一段时间;便于分液漏斗中的液体流下;减小液体流下引起气体体积误差
(6)C
【解析】解:(1)Na2CO3与NaHCO3混合物中碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,坩埚中发生反应的化学方程式为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑,所以答案是:2NaHCO3
Na2CO3+H2O+CO2↑,所以答案是:2NaHCO3 ![]() Na2CO3+H2O+CO2↑;(2)①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为Bg;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为Dg,依据计算方法分析,需要的数值为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为Bg;③加热;④冷却,称量至恒重得到反应后固体质量,则反应前后质量差为(B﹣A﹣D),结合反应2NaHCO3
Na2CO3+H2O+CO2↑;(2)①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为Bg;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为Dg,依据计算方法分析,需要的数值为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为Bg;③加热;④冷却,称量至恒重得到反应后固体质量,则反应前后质量差为(B﹣A﹣D),结合反应2NaHCO3 ![]() Na2CO3+H2O+CO2↑,前后固体质量差计算混合物中碳酸氢钠的质量,碳酸钠质量为B﹣A﹣碳酸氢钠质量,计算得到碳酸钠质量质量分数,所以需要数值为A、B和D,
Na2CO3+H2O+CO2↑,前后固体质量差计算混合物中碳酸氢钠的质量,碳酸钠质量为B﹣A﹣碳酸氢钠质量,计算得到碳酸钠质量质量分数,所以需要数值为A、B和D,
所以答案是:A、B、D;(3)根据溶液稀释过程中溶质氯化氢守恒可计算出盐酸的体积= ![]() =5.00mL,定容时俯视刻度线,将导致配制的溶液的体积偏小,所以会导致溶液的浓度偏高,
=5.00mL,定容时俯视刻度线,将导致配制的溶液的体积偏小,所以会导致溶液的浓度偏高,
所以答案是:5.00;偏高;(4)根据反应 H++CO32﹣=HCO3﹣ ,
0.020L×0.100mol/L 0.002mol
m(Na2CO3)=0.002mol×106g/mol=0.212g
碳酸钠质量分数= ![]() ×100%=70.7%;
×100%=70.7%;
所以答案是:70.7%;(5)在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b,若装置不漏气,由于分液漏斗上面容器中压强小,里面的液体不能完全流下,其现象是水流下一段时间后不再流出,且持续一段时间,导管c连接分液漏斗和蒸馏烧瓶,使两容器中压强相等,便于分液漏斗中的液体流下,同时减小液体流下引起气体体积误差,所以答案是:水流下一段时间后不再流出,且持续一段时间;便于分液漏斗中的液体流下;减小液体流下引起气体体积误差;(6)为了提高测定的准确性,测量气体体积应选用量气管更准确,应选择AC装置进行测定;
所以答案是:C.


科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(夹持装置略,气密性已检验)如图所示。下列推断不合理的是

A. B中收集到的气体是氢气
B. 烧杯中双氧水溶液的作用是将Fe2+ 氧化为Fe3+
C. A中存在氧化铁与盐酸反应生成氯化铁的反应
D. 向反应后的烧杯中通入少量SO2,溶液颜色将立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( ) 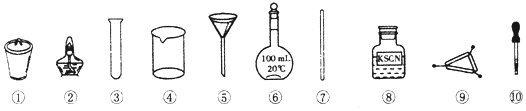
A.将茶叶灼烧灰化,选用②、④和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示: 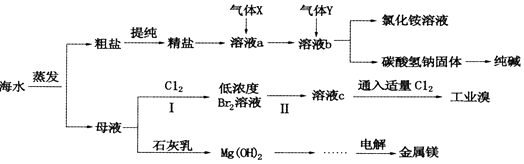
(1)利用海水可制备C12 , 为便于储存,可将C12液化,应采取的措施之一是 .
(2)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解 ②加过量的BaCl2溶液 ③加过量的NaOH溶液 ④加过量的Na2CO3溶液 ⑤(填操作名称,下同) ⑥加适量的盐酸 ⑦
(3)气体X为 . 溶液b中发生反应的化学方程式是 .
(4)步骤I中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 其目的为 . 步骤Ⅱ中通入空气吹出Br2 , 用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为 . 在实验室中,从工业溴中提取溴单质的实验操作名称是 .
(5)工业上制取金属镁的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是除去括号内杂质的有关操作,其中正确的是( )
A.乙醇(乙醛)﹣﹣加水,振荡静置后分液
B.乙酸乙酯(乙酸)﹣﹣加乙醇、浓硫酸加热
C.乙烯(乙炔)﹣﹣将气体通过盛KMnO4溶液的洗气瓶
D.苯(苯酚)﹣﹣加足量NaOH溶液,振荡静置后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是( )
A.AlCl3
B.Na2O
C.FeCl2
D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21∶8,
则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )
A. 1∶2∶1 B. 2∶1∶1 C. 1∶1∶1 D. 2∶3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氯元素同周期且金属性最强的元素位于周期表的第____周期___族。与该元素相邻的短周期主族元素原子半径从大到小的顺序是_____(用元素符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com