
【题目】下列气体分子中不含共价键的是
A. NH3 B. O2 C. Ar D. HCl
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】铝土矿是工业生产金属铝的原料,铝土矿的主要成分为氧化铝和水,另外还含有杂质Fe2O3、SiO2等,下图是工业冶炼铝的流程:

回答下列问题:
(1)如流程图所示,第一步为溶解过程,即在铝土矿中加入硫酸,发生反应的离子方程式为____。该过程一般选用硫酸,而不选用盐酸,原因是____。
(2)滤渣I的成分是____(写化学式,下同),滤渣II的成分是____。
(3)实际工业操作中,流程图中的试剂a和试剂b必须过量,试剂a为____,试剂b为____,流程图中,“滤液II”的溶质为____。
(4)一次生产中,铝土矿中氧化铝的含量为48.6%,三次过滤操作中铝的损失率均为6.8%,电解过程中的转化率为92%,其他操作过程没有铝的损失,那么2.00 t 铝土矿可冶炼出金属铝__t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
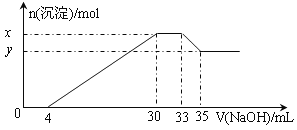
A. X与Y的差值为0.01 mol
B. 原溶液中c(Cl-)=0.66mol·L-1
C. 原溶液的c(H+)=0.8 mol·L-1
D. 原溶液中n(Mg2+)∶n(Al3+)=10∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S气体。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,氢硫酸为弱酸。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作应该是__________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为_______________________________________________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂_______________________________________________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。(在答题卡上画)____________
(6)FeCl3溶液与H2S气体反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是一种常用的氧化剂.不同条件下高锰酸钾可发生如下反应:
①MnO4﹣+5e﹣+8H+═Mn2++4H2O
②MnO4﹣+3e﹣+2H2O═MnO2+4OH﹣
③MnO4﹣+e═MnO42﹣(溶液绿色)
(1)从上述三个半反应中可以看出MnO4﹣的还原产物与溶液的有关.
(2)用草酸(H2C2O4)的稀溶液可以洗涤粘在皮肤上的高锰酸钾,其中的变化:H2C2O4→CO2↑.写出该反应的离子方程式: .
(3)将PbO2粉末投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是(填字母).
a.氧化性强弱:PbO2>KMnO4
b.还原性强弱:PbO2>KMnO4
c.该反应可以用盐酸酸化
d.PbO2发生还原反应:PbO2+SO42﹣+4H++2e﹣═PbSO4+2H2O
(4)用KMnO4可以测定H2O2溶液的有效含量:取15.00mL某浓度H2O2溶液,逐滴加入0.03mo1L﹣1 KMnO4溶液(已酸化),产生无色气体,至终点时共消耗20.00mL KMnO4溶液.
①写出反应的离子方程式;
②溶液中c(H2O2)=molL﹣1;
③反应中转移电子数目mo1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为A g ②称量装有试样的坩埚质量为B g ③加热④冷却⑤称量坩埚和残余物的质量为C g⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式为 .
(2)计算Na2CO3质量分数必须用到的测定数据为(填“A”、“B”、“C”或“D”).
乙方案:
在天平上准确称取0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mo1L﹣1 , 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3 . 重复上述操作两次,消耗盐酸的体积为20.00mL.
(3)配制上述盐酸标准溶液100mL,若用2.0molL﹣1HCl进行配制,需用滴定管量取该HCl溶液mL;定容时俯视刻度线,将导致配制的溶液浓度(填“偏高”、“偏低”或“没有影响”).
(4)样品中Na2CO3的质量分数为(用百分数表示,精确到0.1%).
丙方案:称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.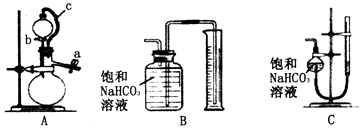
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若装置不漏气,则观察到的现象为 . 实验时,装置A中c的作用、 .
(6)为了提高测定的准确性,应选用装置A和(填写字母标号)进行实验.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B. 氢氧化铝跟醋酸溶液反应:2Al(OH)3+6H+ =2Al3++6H2O
C. 小苏打溶液中滴入烧碱溶液: HCO3- + OH- = 2H2O + CO32-
D. 偏铝酸钠溶液与过量稀盐酸反应:AlO2-+H++H2O=Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com