
【题目】NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA
B.23g Na 与足量H2O反应完全后可生成NA个H2分子
C.标准状况下,22.4LN2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去8 NA个电子
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
(1)写出肼的电子式 , 1mol N2H4中有个极性共价键.
(2)NH3与NaClO反应可以得到肼,该反应的化学方程式为 .
(3)发射火箭时,肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水.已知1.6g液态N2H4在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式: .
(4)肼﹣空气燃料电池是一种碱性电池,该电池放电时负极反应式为 .
(5)肼性质与氨气相似,易溶于水,可发生如下电离过程:Ⅰ、N2H4+H2O═N2H5++OH﹣Ⅱ、N2H5++H2O═N2H62++OH﹣
①常温下,某浓度N2H6C12溶液的pH为5,则该溶液中由水电离产生的c(OH﹣)= .
②已知在相同条件下过程I的进行程度大于N2H5+的水解程度.常温下,若0.2mol/L N2H4溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、N2H4H2O、Cl﹣、OH﹣、H+ 粒子浓度由大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量相等的SO2 和SO3,物质的量之比为_________, 硫原子个数之比为______,氧原子的原子个数之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸,乳酸的结构简式为 ![]() .已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
.已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
(1)写出乳酸分子中官能团的名称 .
(2)一定条件下乳酸能发生的反应类型有(填序号).
A.水解反应
B.取代反应
C.加成反应
D.中和反应
E.氧化反应
F.酯化反应
(3)写出乳酸与碳酸钠溶液反应的化学方程式 .
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有转化关系(其他产物及反应所需条件均已略去).
A ![]() B
B ![]() C
C ![]() D
D ![]() E
E ![]() F,以下推断错误的是( )
F,以下推断错误的是( )
A.当X是盐酸时,则F是稀硝酸
B.当X是氢氧化钠时,则F是稀硝酸
C.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
D.当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答: 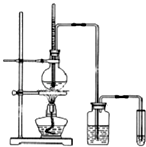
(1)写出圆底烧瓶中反应的方程式 , 反应类型;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:;
(3)为了检验乙烯的生成,试管中应盛放 , 现象为;
(4)洗瓶中盛放的试剂为 , 作用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因__________
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是_________________。
(3)某小组同学用如图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )

A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com