
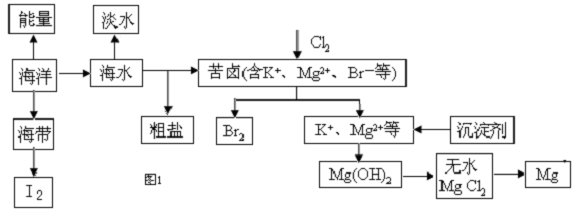
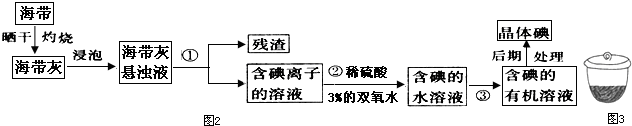

分析 (1)利用蒸馏法控制水的沸点100°C,使水变为蒸气通过冷凝得到蒸馏水,能使海水淡化,但成本较高;
(2)i、溶固体在坩埚中灼烧,分离固体和液体用过滤;
ii、过程②中有关反应是碘离子为碘单质;
iii、萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(3)i、第①步和第③步发生的离子方程式相同,均生成Br2,目的是富集溴;
ii、吸收塔内是吸收空气吹出的溴蒸汽,吸收剂为二氧化硫,和溴单质反应生成硫酸和溴化氢;
(4)i、沉淀镁离子为氢氧化钙结合镁离子形成沉淀;
ii、无水氯化镁熔融电解生成镁和氯气.
解答 解:(1)在海水获去得淡水的诸多方法中,历史最久,技术和工艺也比较成熟,但成本较高的方法是蒸馏法,
故答案为:蒸馏法;
(2)i、将海带放在如3图所示的仪器中灼烧,该仪器为坩埚,过滤适用于不溶于水的固体和液体,提取碘的过程中有关的实验操作名称①为过滤,
故答案为:坩埚;过滤,
ii、过程②中有关反应是碘离子为碘单质,反应的离子方程式为:2I-+2H++H2O2=I2+2H2O,
故答案为:2I-+2H++H2O2=I2+2H2O;
iii、萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,
a.酒精、四氯化碳,酒精易溶于水,不能分层,故a错误;
b.四氯化碳、苯符合萃取剂的要求,可以萃取分液,故b正确;
c.汽油、醋酸中醋酸是溶于水的不能分层,不能做萃取剂,故c错误;
故答案为:b;
(3)i、第①步和第③步发生的离子方程式相同,均生成Br2,是利用过氧化氢氧化溴离子为溴单质,溴单质被二氧化硫氧化生成溴化氢,通入氯气氧化溴化氢为溴单质,操作的目的是富集溴,
故答案为:富集溴;
ii、吸收塔内是吸收空气吹出的溴蒸汽,吸收剂为二氧化硫,和溴单质反应生成硫酸和溴化氢,吸收剂A为二氧化硫,选择c,
故答案为:c;
(4)i、向苦卤提溴之后的溶液中加入沉淀剂,沉淀镁离子为氢氧化钙结合镁离子形成沉淀,氢氧化钙来源丰富且廉价,故选b,
故答案为:b;
ii、无水氯化镁熔融电解生成镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查学生卤素单质的性质,物质含量测定的实验设计和数据获得,溴单质的提取流程分析判断,出题方式新颖,有一定的思维空间,题目难度中等.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 一个N≡N断裂的同时,有3个H-H键断裂 | |
| B. | 保持其它条件不变时,体系压强不再改变 | |
| C. | 恒温恒容时,密度保持不变 | |
| D. | 正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤③② | B. | ①②④⑤③ | C. | ①④②③ | D. | ①④②⑤③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-) | B. | c(HAc)>c(Cl-)>c(Ac-)>c(H+) | ||
| C. | c(Ac-)>c(Cl-)>c(HAc)>c(H+) | D. | c(Ac-)=c(Cl-)=c(HAc)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3c-a-b | B. | a+b-3c | C. | a+3b-2c | D. | a+3b-6c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 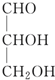 | B. | 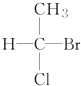 | C. | CH3CH2OH | D. | 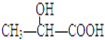 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基(-OH)含有10NA个电子 | |
| B. | 在20gH218O中含有10NA个中子 | |
| C. | 标准状况下,22.4L四氯化碳含有NA个四氯化碳分子 | |
| D. | 1mol乙醇分子中含有共用电子对数目为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com