
| A. | c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-) | B. | c(HAc)>c(Cl-)>c(Ac-)>c(H+) | ||
| C. | c(Ac-)>c(Cl-)>c(HAc)>c(H+) | D. | c(Ac-)=c(Cl-)=c(HAc)>c(H+) |
分析 二者混合后,溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa、NaCl,溶液呈酸性,说明CH3COO-的水解程度小于CH3COOH电离程度,据此分析解答.
解答 解:二者混合后,溶液中的溶质为等物质的量浓度的HAc、NaAc、NaCl,溶液呈酸性,说明Ac-的水解程度小于HAc电离程度,
A.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(Ac-)+c(OH-)+c(Cl-),故A正确;
B.醋酸电离程度大于醋酸根离子水解程度,所以c(Ac-)>c(Cl-)>c(HAc),故B错误;
C.醋酸电离程度大于醋酸根离子水解程度,但电离和水解程度都较小,所以c(Ac-)>c(Cl-)>cHAc)>c(H+),故C正确;
D.醋酸电离程度大于醋酸根离子水解程度,氯离子不水解,所以c(Ac-)>c(Cl-)>c(HAc),故D错误;
故选AC.
点评 本题考查离子浓度大小比较,明确混合溶液中的电解质及溶液酸碱性是解本题关键,注意:任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液酸碱性及浓度无关,为易错点,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
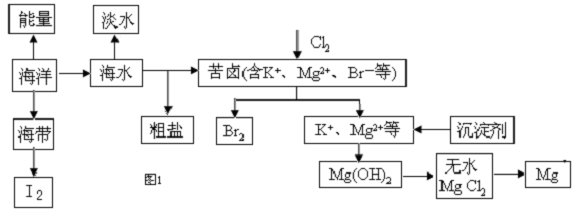
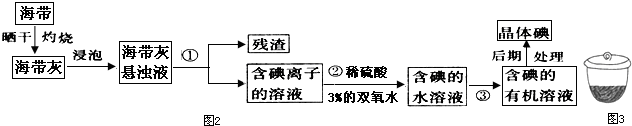

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷加氢氧化钠溶液加热后,再加AgNO3溶液有浅黄色沉淀生成 | |
| B. | 实验室用分液漏斗分离苯和溴苯的混合物 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,直至产生的沉淀恰好溶解为止 | |
| D. | 除去苯中的少量苯酚,可用先加浓溴水,充分沉淀后过滤即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2×10-10mol/L | B. | $\frac{1}{2}$(10-8+10-10)mol/L | ||
| C. | (10-8+10-10)mol/L | D. | $\frac{1}{2}$(10-6+10-4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
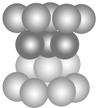
| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com