

分析 (1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,碱石灰可以吸收酸性气体,并用于干燥氨气;
(2)①NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体;
②由于2NO2(g)?N2O4(g);△H<0,正反应为放热反应,当温度降低时,平衡向正反应方向移动,依次进行判断;
(3)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
解答 解:(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3.
故答案为:(NH4)2CO3 或NH4HCO3;
(2)①NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2.
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;2NO+O2═2NO2;
②将试管浸入冰水中,由于2NO2(g)?N2O4(g)△H<0,正反应为放热反应,当温度降低时,平衡向正反应方向移动,部分红棕色的NO2转化为无色N2O4,故颜色变浅.
故答案为:2NO2?N2O4 △H<0,降温平衡向正反应方向移动,颜色变浅;
(3)①由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染,
故答案为:先通O2,后通NH3;若先通NH3,氨气在空气中不能燃烧,逸出造成环境污染;
②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O(O2置换N2).
故答案为:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
点评 本题为信息给予题,考查氨气的有关性质,做题时注意题中“氨气可在纯氧中安静燃烧…”这一重要信息,结合氨气的性质解答问题,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)分子式为C8H10,含有苯环的同分异构体有4种;其中苯环上的一个氢原子被氯原子取代后产生同分异构体数目最少的是
(1)分子式为C8H10,含有苯环的同分异构体有4种;其中苯环上的一个氢原子被氯原子取代后产生同分异构体数目最少的是 ; (填结构简式)
; (填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一个N≡N断裂的同时,有3个H-H键断裂 | |
| B. | 保持其它条件不变时,体系压强不再改变 | |
| C. | 恒温恒容时,密度保持不变 | |
| D. | 正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X是制取聚乙烯的单体 | |
| B. | 乙酸→W是酯化反应,也是取代反应 | |
| C. | Y能与钠反应产生氢气 | |
| D. | W能与NaOH溶液反应但不能与硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
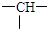 ,它可能的结构数目是( )
,它可能的结构数目是( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- | |
| B. | 该溶液中一定含有K+、AlO2-、CO32-、Cl- | |
| C. | 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) | |
| D. | 可能含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-) | B. | c(HAc)>c(Cl-)>c(Ac-)>c(H+) | ||
| C. | c(Ac-)>c(Cl-)>c(HAc)>c(H+) | D. | c(Ac-)=c(Cl-)=c(HAc)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com