
| A. | 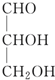 | B. | 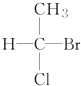 | C. | CH3CH2OH | D. | 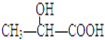 |
分析 根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的.
解答 解:A.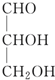 中间的碳原子连有的四个不同取代基,该碳原子具有手性,故A错误;
中间的碳原子连有的四个不同取代基,该碳原子具有手性,故A错误;
B. 底下的碳原子连有的四个不同取代基,该碳原子具有手性,故B错误;
底下的碳原子连有的四个不同取代基,该碳原子具有手性,故B错误;
C.CH3CH2OH中一个碳原子所连接的四个基团有3个是一样的,另一个碳原子所连接的四个基团有2个是一样的,碳原子没有手性,故C正确;
D.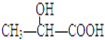 中间的碳原子连有的四个不同取代基,该碳原子具有手性,故D错误.
中间的碳原子连有的四个不同取代基,该碳原子具有手性,故D错误.
故选C.
点评 本题主要考查手性碳原子的判断,难度不大,手性碳原子判断注意:手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同的.


科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 3种 | C. | 4种 | D. | 多于4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
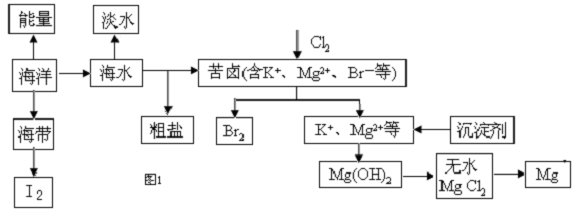
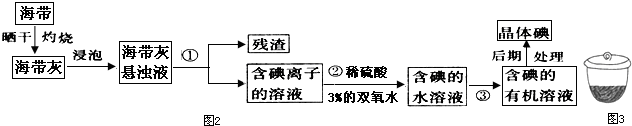

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2×10-10mol/L | B. | $\frac{1}{2}$(10-8+10-10)mol/L | ||
| C. | (10-8+10-10)mol/L | D. | $\frac{1}{2}$(10-6+10-4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和 C3H4,体积比为 1:1 | B. | C2H2和 C2H6,体积比为 3:1 | ||
| C. | C2H4和C2H6,体积比为 2:1 | D. | C2H2和 C2H4,体积比为 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
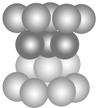
| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H60 | B. | C30H56 | C. | C30H52 | D. | C30H50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com