
【题目】某化学兴趣小组用一定量铜片和50 mL浓度为2.0 mol/L的硝酸反应,当铜片完全溶解时收集到标准状况下280 mL的一氧化氮。请回答(忽略溶液体积变化):
(1)反应后溶液呈_______性(用“酸”、“碱”或“中”填空);
(2)反应后溶液中铜离子的物质的量浓度是多少_______(写出计算过程,保留三位有效数字)?
【答案】酸 0.375 mol/L
【解析】
由硝酸的浓度和体积可计算硝酸的物质的量,Cu与稀硝酸反应产生Cu(NO3)2、NO、H2O,根据NO的体积确定反应消耗的HNO3的物质的量,结合题目给出的硝酸的物质的量可判断溶液的酸碱性;根据反应方程式中Cu(NO3)2、NO的关系计算Cu(NO3)2的物质的量,然后由物质的量浓度定义式计算铜离子的物质的量浓度。
(1)n(HNO3)=c·V=2.0 mol/L×0.050 L=0.10 mol,标准状况下280 mL的一氧化氮的物质的量n(NO)=![]() =0.0125 mol,根据Cu与稀硝酸反应的方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知:反应消耗8 mol HNO3,会同时产生3 mol Cu(NO3)2、2 molNO,则反应产生0.0125 molNO,就会消耗硝酸的物质的量为4 n(NO)=4×0.0125 mol=0.05 mol,加入的硝酸的物质的量为0.10 mol>0.05 mol,硝酸过量,所以反应后溶液显酸性;
=0.0125 mol,根据Cu与稀硝酸反应的方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知:反应消耗8 mol HNO3,会同时产生3 mol Cu(NO3)2、2 molNO,则反应产生0.0125 molNO,就会消耗硝酸的物质的量为4 n(NO)=4×0.0125 mol=0.05 mol,加入的硝酸的物质的量为0.10 mol>0.05 mol,硝酸过量,所以反应后溶液显酸性;
(2)根据(1)可知 n(NO)=0.0125 mol,根据物质反应转化关系可知反应产生Cu(NO3)2的物质的量为![]() n(NO)=
n(NO)=![]() ×0.0125 mol=0.01875 mol,由于溶液的体积是50 mL,所以反应后Cu(NO3)2的物质的量你的c[Cu(NO3)2]=
×0.0125 mol=0.01875 mol,由于溶液的体积是50 mL,所以反应后Cu(NO3)2的物质的量你的c[Cu(NO3)2]=![]() =0.375 mol/L。
=0.375 mol/L。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )
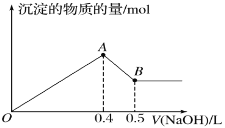
A.3∶1B.4∶1C.5∶1D.6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
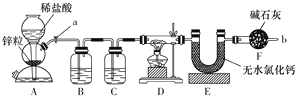
(1)装置B的作用是______________ ,装置C中盛装的液体是______________。
(2)在硬质双通玻璃管中发生的化学反应方程式是_______________________。
(3)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U型管的质量增加7.2 g,则混合物中Fe2O3的质量为______________。
(4)U型管E右边连接干燥管F的目的是________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,10Fe2++2Br-+6Cl2=Br2+12Cl-+10Fe3+
C.x=a,Fe2++2Br-+2Cl2=Br2+Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L四氯化碳中含有的分子数0.5NA
B.常温常压下,18.0 g水所含的电子数为10 NA
C.300mL 0.1mol/L的NaCl的溶液含有0.03NA个NaCl分子
D.1.2 g熔融的NaHSO4含有阴阳离子总数为0.03NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1 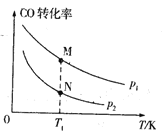 图2
图2 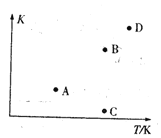
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
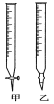
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com