
【题目】含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,10Fe2++2Br-+6Cl2=Br2+12Cl-+10Fe3+
C.x=a,Fe2++2Br-+2Cl2=Br2+Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
【答案】C
【解析】
由于还原性:Fe2+>Br-,通入Cl2,依次发生2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,当n(Cl2):n(FeBr2)≤![]() 时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥
时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥![]() 时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,据此分析解答问题。
时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,据此分析解答问题。
A.x=0.4a,n(Cl2):n(FeBr2)=0.4<![]() ,只氧化Fe2+,A选项正确;
,只氧化Fe2+,A选项正确;
B.x=0.6a,n(Cl2):n(FeBr2)介于![]() ~
~![]() ,Fe2+被完全氧化,Br-被部分氧化,反应方程式为10Fe2++2Br-+6Cl2=Br2+12Cl-+10Fe3+,B选项正确;
,Fe2+被完全氧化,Br-被部分氧化,反应方程式为10Fe2++2Br-+6Cl2=Br2+12Cl-+10Fe3+,B选项正确;
C.x=a,n(Cl2):n(FeBr2)介于![]() ~
~![]() ,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,C选项错误;
,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,C选项错误;
D.x=1.5a,Fe2+和Br-恰好被完全氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,D选项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用一定量铜片和50 mL浓度为2.0 mol/L的硝酸反应,当铜片完全溶解时收集到标准状况下280 mL的一氧化氮。请回答(忽略溶液体积变化):
(1)反应后溶液呈_______性(用“酸”、“碱”或“中”填空);
(2)反应后溶液中铜离子的物质的量浓度是多少_______(写出计算过程,保留三位有效数字)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.在含![]() 个硅原子的二氧化硅晶体中含有
个硅原子的二氧化硅晶体中含有![]() 个
个![]() 键
键
B.![]() 与
与![]() 的分子结构都是正四面体形,因此在
的分子结构都是正四面体形,因此在![]() 个
个![]() 分子或
分子或![]() 分子中都含有
分子中都含有![]() 个共价键
个共价键
C.5.6g![]() 与含0.2mol
与含0.2mol![]() 的溶液充分反应,至少失去
的溶液充分反应,至少失去![]() 个电子
个电子
D.![]() 个
个![]() 完全水解可以得到
完全水解可以得到![]() 个氢氧化铁胶体
个氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,回答下列问题:
(1)用白醋浸泡开水壶,第二天发现壶内水垢消失,开水壶又光洁如新了(水垢的主要成分是碳酸钙等)。该离子反应方程式为____________。
(2)食盐不慎洒落在天然气的火焰上,观察到的现象是_____,该变化称为_____反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是____________。
(4)面包在制作时会加入小苏打,利用其加热产生气体的性质,可将小苏打作为膨松剂,该反应的化学方程式是________________。
(5)光导纤维、沙子、石英和玛瑙的主要成分是__________(填化学式)。
(6)赏心悦目的雕花玻璃是用__________(填名称)对玻璃进行刻蚀而制成的。
(7)使用“84”消毒液(含NaClO)时,按一定比例将它与水混合,并在空气中浸泡一段时间,使NaClO与H2O及空气中的CO2充分反应,以达到杀菌消毒的效果更好的目的。将该反应的离子方程式补充完整:![]() ____+____。
____+____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________
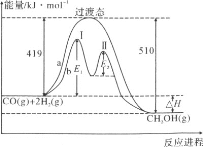
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:
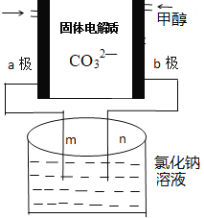
①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com