
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
【答案】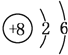 Na CD Na2O2 > Al(OH)3+OH-=AlO2-+2H2O
Na CD Na2O2 > Al(OH)3+OH-=AlO2-+2H2O
【解析】
T最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;X在常温下单质分子为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子M层比K层少1个电子,则M层电子数为1,Y为Na元素;第三周期元素的简单离子中Z的半径最小,则Z为Al元素。然后根据元素的原子结构与物质性质的关系分析解答。
根据上述分析可知:T是O,X是N,Y是Na,Z是Al。
(1)T为O元素,核外电子排布是2、6,所以O原子结构示意图为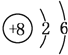 ;
;
(2)Na、Al是同一周期的元素,原子序数越大,元素金属性越弱,所以金属性Na>Al;
A.单质的熔点属于物理性质,不能比较金属性强弱,A错误;
B.金属性强弱与失去电子难易有关,与失去电子数目多少无关,即与化合价高低无关,B错误;
C.元素的金属性越强,单质与水或酸反应就越剧烈,所以Na单质与水反应比Al单质剧烈,可以说明Na金属性更强,C正确;
D.元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。Na最高价氧化物的水化物NaOH的碱性比Al的最高价氧化物的水化物Al(OH)3强,说明钠的金属性更强,D正确;
故合理选项是CD;
(3)在O、N、Na、Al中,有两种元素能形成既有离子键又有共价键的化合物,该化合物为Na2O2;
(4)O可以形成稳定的阴离子O2-,Na可以形成稳定的阳离子Na+,二者核外电子层结构相同,核电荷数越大,离子半径就越小,所以离子半径:O2->Na+;
(5)N、Na、Al的最高价氧化物对应的水化物分别是HNO3、NaOH、Al(OH)3,三种物质可以相互发生反应,其中Na、Al的最高价氧化物对应的水化物NaOH、Al(OH)3之间反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】某一定量有机物和足量Na反应得到![]() L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得
L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得![]() L二氧化碳,若在同温同压下
L二氧化碳,若在同温同压下![]() =
=![]() ≠0,则该有机物可能是
≠0,则该有机物可能是
①CH3CH(OH)COOH ②HOOC—COOH
③CH3CH2COOH④HOOCCH2CH(OH)CH2COOH ⑤CH3CH(OH)CH2OH
A. ② B. ②③④ C. 只有④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④SiO2;⑤蔗糖晶体;⑥NaOH;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(1)上述物质中属于电解质的有____(填序号),向⑦中逐滴滴入过量的①的水溶液,出现的实验现象是___。
(2)用④与⑥焙烧制备硅酸钠,可采用图中的装置为____(填选项编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
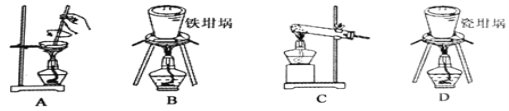
【题目】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)装置B的作用是______________ ,装置C中盛装的液体是______________。
(2)在硬质双通玻璃管中发生的化学反应方程式是_______________________。
(3)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U型管的质量增加7.2 g,则混合物中Fe2O3的质量为______________。
(4)U型管E右边连接干燥管F的目的是________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A.若升高温度,X的体积分数增大,则该反应的△H<0
B.若增大压强,则物质Y的转化率减小
C.以X浓度变化表示的反应速率为0.01mol/(L·s)
D.将容器体积变为20L,Z的平衡浓度为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,10Fe2++2Br-+6Cl2=Br2+12Cl-+10Fe3+
C.x=a,Fe2++2Br-+2Cl2=Br2+Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1 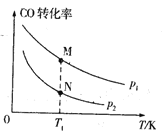 图2
图2 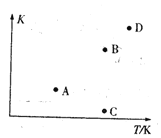
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀与加入氢氧化钠体积(mL)情况如图所示。下列说法不正确的是( )

A.原溶液中c(HNO3)=1.8mol/LB.沉淀最大质量为4.08g
C.n(Mg):n(Al)=1:1D.氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com