
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A.若升高温度,X的体积分数增大,则该反应的△H<0
B.若增大压强,则物质Y的转化率减小
C.以X浓度变化表示的反应速率为0.01mol/(L·s)
D.将容器体积变为20L,Z的平衡浓度为原来的![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.碳酸氢铵溶液与少量氢氧化钠溶液:![]()
B.氢氧化镁和盐酸反应:![]()
C.氨水与盐酸反应:![]()
D.碳酸钙溶于稀醋酸中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
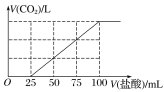
A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知异丁烷的分子结构可简写成键线式结构为![]() 。有机物X的键线式结构为
。有机物X的键线式结构为![]() ,有机物Y与等物质的量的H2发生加成反应可得到有机物X。下列有关说法错误的是( )
,有机物Y与等物质的量的H2发生加成反应可得到有机物X。下列有关说法错误的是( )
A. 有机物X的一氯代物只有4种
B. 用系统命名法命名有机物X名称为2,2,3-三甲基戊烷
C. 有机物X的分子式为C8H18
D. Y的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.在含![]() 个硅原子的二氧化硅晶体中含有
个硅原子的二氧化硅晶体中含有![]() 个
个![]() 键
键
B.![]() 与
与![]() 的分子结构都是正四面体形,因此在
的分子结构都是正四面体形,因此在![]() 个
个![]() 分子或
分子或![]() 分子中都含有
分子中都含有![]() 个共价键
个共价键
C.5.6g![]() 与含0.2mol
与含0.2mol![]() 的溶液充分反应,至少失去
的溶液充分反应,至少失去![]() 个电子
个电子
D.![]() 个
个![]() 完全水解可以得到
完全水解可以得到![]() 个氢氧化铁胶体
个氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下,下列说法错误的是 ( )
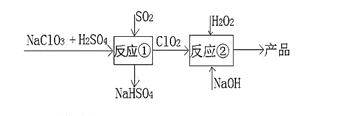
A.反应①阶段,参加反应的 NaClO3 和 SO2 的物质的量之比为 2:1
B.反应②中的 H2O2 可以用 NaClO4 代替
C.反应②条件下,ClO2 的氧化性大于 H2O2
D.根据流程信息,可推测 NaClO3 氧化性强于 NaClO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com