
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下,下列说法错误的是 ( )
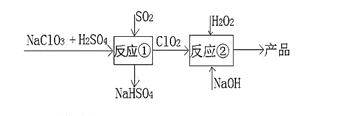
A.反应①阶段,参加反应的 NaClO3 和 SO2 的物质的量之比为 2:1
B.反应②中的 H2O2 可以用 NaClO4 代替
C.反应②条件下,ClO2 的氧化性大于 H2O2
D.根据流程信息,可推测 NaClO3 氧化性强于 NaClO2
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A.若升高温度,X的体积分数增大,则该反应的△H<0
B.若增大压强,则物质Y的转化率减小
C.以X浓度变化表示的反应速率为0.01mol/(L·s)
D.将容器体积变为20L,Z的平衡浓度为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )

A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对某类反应[aA(g)+bB(g)cC(g)]的化学平衡的影响,得到图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)
反应Ⅰ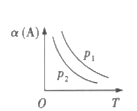 反应Ⅱ
反应Ⅱ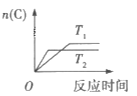
分析图像,回答下列问题:
(1)在反应I中,若![]() >
>![]() ,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
(2)在反应II中,![]() __________(填“>”,“<”或“=”)
__________(填“>”,“<”或“=”)![]() ,该反应的正反应为__________(填“放热”或“吸热”)反应。
,该反应的正反应为__________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
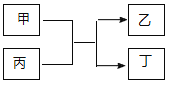
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀与加入氢氧化钠体积(mL)情况如图所示。下列说法不正确的是( )

A.原溶液中c(HNO3)=1.8mol/LB.沉淀最大质量为4.08g
C.n(Mg):n(Al)=1:1D.氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】头孢拉定又名先锋霉素,是常用的一种抗生素,其结构简式如图:
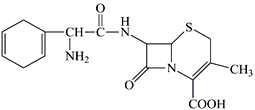
下列说法不正确的是( )
A. 头孢拉定的分子式是C16H19N3O4S,分子中有多种官能团
B. 头孢拉定与Na2CO3溶液、NaHCO3溶液都可以反应
C. 1mol头孢拉定最多可与6molH2和5mol Br2发生加成反应
D. 头孢拉定既可与盐酸反应,也可与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com