
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀与加入氢氧化钠体积(mL)情况如图所示。下列说法不正确的是( )

A.原溶液中c(HNO3)=1.8mol/LB.沉淀最大质量为4.08g
C.n(Mg):n(Al)=1:1D.氢氧化钠溶液浓度为3mol/L
【答案】A
【解析】
将一定质量的镁铝合金投入100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中逐滴加入NaOH溶液,根据图示可知,0~10mL段氢氧化钠和H+反应,10~60mL段氢氧化钠沉淀Al3+和Mg2+,60~70mL的氢氧化钠溶解生成的Al(OH)3沉淀;根据NO得电子,金属失电子,由电荷守恒可知,n(e-)=n(OH-),即可求出氢氧化钠的物质的量浓度;根据各段反应求出沉淀的物质的量,进而求出金属的质量之比;根据钠的守恒即可求出溶液中n(NO3-),根据N原子守恒,即可求出原硝酸溶液中硝酸的物质的量和浓度,据此分析。
1.12LNO气体(标准状况)的物质的量为:![]() =0.05mol,转移电子为:0.05mol×(5-2)=0.15mol,NO得电子,金属失电子,由电荷守恒可知,n(e-)=n(OH-),当生成沉淀最多时,两金属离子反应消耗的氢氧化钠为n(NaOH)=0.15mol,c(NaOH)=
=0.05mol,转移电子为:0.05mol×(5-2)=0.15mol,NO得电子,金属失电子,由电荷守恒可知,n(e-)=n(OH-),当生成沉淀最多时,两金属离子反应消耗的氢氧化钠为n(NaOH)=0.15mol,c(NaOH)=![]() =3mol/L;开始反应到沉淀最大值一共消耗60mLNaOH,生成硝酸钠为n(NaNO3)=3mol/L×0.06L=0.18mol,则原来的硝酸为:0.18mol+0.05mol=0.23mol,c(HNO3)=
=3mol/L;开始反应到沉淀最大值一共消耗60mLNaOH,生成硝酸钠为n(NaNO3)=3mol/L×0.06L=0.18mol,则原来的硝酸为:0.18mol+0.05mol=0.23mol,c(HNO3)=![]() =2.3mol/L;沉淀减少消耗NaOH为10mL,由OH-~Al(OH)3,故可知氢氧化铝沉淀为0.03mol,与镁离子反应的氢氧化钠为50mL-30mL=20mL,则由2OH-~Mg(OH)2,故可知氢氧化镁沉淀为0.03mol;
=2.3mol/L;沉淀减少消耗NaOH为10mL,由OH-~Al(OH)3,故可知氢氧化铝沉淀为0.03mol,与镁离子反应的氢氧化钠为50mL-30mL=20mL,则由2OH-~Mg(OH)2,故可知氢氧化镁沉淀为0.03mol;
A.由分析可知,c(HNO3)=2.3mol/L,故A错误;
B.氢氧化镁沉淀为0.03mol,氢氧化铝沉淀为0.03mol,则沉淀的最大质量为0.03mol×58g/mol+0.03mol×78g/mol=4.08g,故B正确;
C.氢氧化铝沉淀为0.03mol,则Al的物质的量为0.03mol,质量为:27g/mol×0.03mol=8.1g;氢氧化镁沉淀为0.03mol,由Mg元素守恒可得:n(Mg)=0.03mol,则n(Mg):n(Al)=0.03mol:0.03mol=1:1,故C正确;
D.由分析可知,NaOH的物质的量浓度为3mol/L,故D正确;
故答案为A。


科目:高中化学 来源: 题型:
【题目】某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是:( )
①N2→NO2②NO2→NO ③NH3→NO
④NH3→NO2⑤Cu→Cu(NO3)2⑥HNO3→NO2
A.①⑥B.②⑤C.④⑤D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
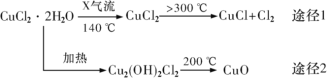
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为蔗糖酶作用机理示意图,下列说法正确的是( )

A.该示意图说明酶具有高效性
B.图示过程能够保证酶保持较高的催化活性
C.一分子蔗糖可以水解为2分子葡萄糖
D.蔗糖酶不能催化麦芽糖水解是因为它们不能结合形成酶﹣底物复合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。
(2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计如图工艺流程制取硫酸铁铵。
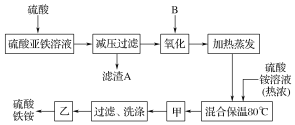
请回答下列问题:
(1)硫酸亚铁溶液加硫酸酸化的主要目的是________。
(2)下列物质中最适合的氧化剂B是________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是_____。
(4)上述流程中,氧化之后和加热蒸发之前,需加入少量______(填化学式),检验Fe2+是否已全部被氧化的方法为_______________。
(5)称取14.00 g所得产品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份溶液中加入足量NaOH溶液,过滤、洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba(NO3)2的溶液,恰好完全反应,则该硫酸铁铵的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com