
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
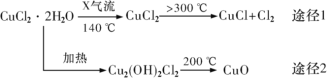
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
【答案】D
【解析】
热分解CuCl22H2O制备CuCl,为抑制CuCl2水解,要在HCl气流下加热,加热温度大于300℃,发生2CuCl2![]() 2CuCl+Cl2↑,直接加热CuCl22H2O会生成Cu2(OH)2Cl2,Cu2(OH)2Cl2加热到200℃生成CuO。
2CuCl+Cl2↑,直接加热CuCl22H2O会生成Cu2(OH)2Cl2,Cu2(OH)2Cl2加热到200℃生成CuO。
A.途径1中产生的Cl2可以转化为HCl,回收循环利用,故A正确;
B.Cu2(OH)2Cl2加热到200℃生成CuO,由原子守恒可知,还生成HCl,则化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑,故B正确;
2CuO+2HCl↑,故B正确;
C.CuCl2水解生成氢氧化铜和HCl,X气体是用于抑制CuCl2水解,则X为HCl,故C正确;
D.CuCl微溶于水,不能写成离子,CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO42-═2Cu2++SO2↑+2Cl-+2H2O,故D错误;
故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.常温下64 g S4和S8混合物中含有原子数为2NA
B.标准状况下,22.4L水中含电子数为10 NA
C.l L1 mol/L的盐酸溶液中,所含氯化氢分子数为NA
D.56 g Fe 与足量氯气反应,转移的电子数为 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
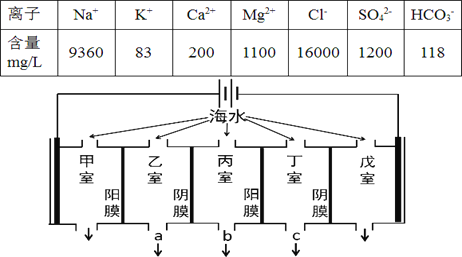
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀与加入氢氧化钠体积(mL)情况如图所示。下列说法不正确的是( )

A.原溶液中c(HNO3)=1.8mol/LB.沉淀最大质量为4.08g
C.n(Mg):n(Al)=1:1D.氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________
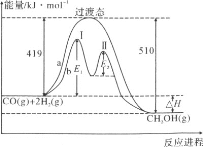
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:
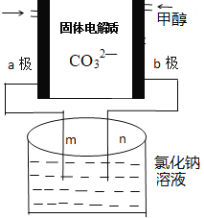
①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释定容为500mL。下列说法不正确的是
A.所得溶液中阳离子和阴离子的物质的量之比为1∶1
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中AlO2-的物质的量浓度为0.2mol/L
D.反应中放出的气体在标准状况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
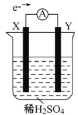 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com