
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
【答案】D
【解析】
A.M(s)→M(g)是吸热过程,则△H1>△H2,故A错误;
B.2SO2(g)+O2(g)![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,由于反应是可逆反应,SO2不可能完全被氧化,所以放出的热量<49.15kJ,故B错误;
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,由于反应是可逆反应,SO2不可能完全被氧化,所以放出的热量<49.15kJ,故B错误;
C.电解精炼铜时,粗Cu作阳极,则电源负极与纯铜相连,但电解精炼铜时,阳极上溶解的金属不仅有铜还有其它金属,阴极上只析出铜,所以溶解的铜小于析出的铜,导致溶液中铜离子浓度减小,故C错误;
D.用惰性电极电解Na2SO4溶液,由于溶液中阴离子的放电顺序为:OH->SO42-,放电为OH-,阳离子放电顺序为:H+>Na+,放电为H+,故实质为电解水:2H2O![]() 2H2↑+O2,当阴极产生1molH2气时,有2mol电子转移时,可加入18g水恢复,故D正确;
2H2↑+O2,当阴极产生1molH2气时,有2mol电子转移时,可加入18g水恢复,故D正确;
故答案为D。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A. 向含等物质的量的![]() 的溶液中缓慢通入氯气:
的溶液中缓慢通入氯气:![]()
B. 向含等物质的量的![]() 的溶液中缓慢加入锌粉:
的溶液中缓慢加入锌粉:![]()
C. 在含等物质的量的![]() 的混合溶液中缓慢通入CO2:
的混合溶液中缓慢通入CO2:![]() 、
、![]()
D. 在含等物质的量的![]() 的溶液中逐滴加入盐酸:
的溶液中逐滴加入盐酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
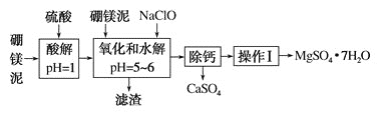
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀与加入氢氧化钠体积(mL)情况如图所示。下列说法不正确的是( )

A.原溶液中c(HNO3)=1.8mol/LB.沉淀最大质量为4.08g
C.n(Mg):n(Al)=1:1D.氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
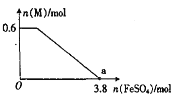
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com