
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
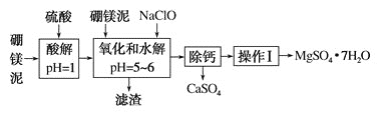
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。
【答案】胶头滴管,100mL容量瓶 ![]()
![]() 取少量滤液于试管中,加入KSCN溶液,若不变红,则除尽 趁热过滤
取少量滤液于试管中,加入KSCN溶液,若不变红,则除尽 趁热过滤
【解析】
⑴实验中需用1 mol·L-1的硫酸900 mL,没有900mL的容量瓶,只能用1000mL容量瓶。
⑵加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,说明生成了氯离子,反应的离子方程式为:ClO- + Mn2+ +H2O= MnO2 + Cl- +2H+,还有一种离子也会被NaClO氧化,亚铁离子也被次氯酸钠氧化生成铁离子和氯离子,其反应的离子方程式为2Fe2++ClO- + 2H+= 2Fe3+ + Cl-+H2O。
⑶在“除钙”前,需检验滤液中Fe3+是否被除尽,主要用KSCN溶液来检验铁离子。
⑷根据上表数据,硫酸钙温度越高溶解度越低,因此要趁热过滤。
⑴实验中需用1 mol·L-1的硫酸900 mL,没有900mL的容量瓶,只能用1000mL容量瓶,因此配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需胶头滴管,100mL容量瓶。
⑵加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,说明生成了氯离子,反应的离子方程式为:ClO- + Mn2+ +H2O= MnO2 + Cl- +2H+,还有一种离子也会被NaClO氧化,亚铁离子也被次氯酸钠氧化生成铁离子和氯离子,其反应的离子方程式为2Fe2++ClO- + 2H+= 2Fe3+ + Cl-+H2O,故答案为:ClO- + Mn2+ +H2O= MnO2 + Cl- +2H+;2Fe2++ClO-+ 2H+= 2Fe3+ + Cl-+H2O。
⑶在“除钙”前,需检验滤液中Fe3+是否被除尽,主要用KSCN溶液来检验铁离子,故答案为:取少量滤液于试管中,加入KSCN溶液,若不变红,则除尽。
⑷根据上表数据,硫酸钙温度越高溶解度越低,因此操作步骤为蒸发结晶、趁热过滤,故答案为:趁热过滤。


科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
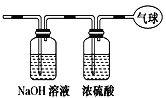
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
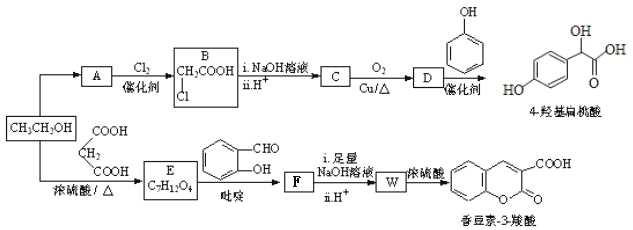
【题目】4-羟基扁桃酸可用于制备抗生素及血管扩张类的药物,香豆素-3-羧酸可用于制造香料,二者合成路线如下(部分产物及条件未列出):
已知;
![]() (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)
(1)A相对分子质量为60,常在生活中用于除去水壶中的水垢,A的结构简式是___________。
(2)D → 4-羟基扁桃酸反应类型是______________。
(3)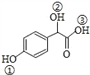 中①、②、③ 3个-OH的电离能力由强到弱的顺序是___________。
中①、②、③ 3个-OH的电离能力由强到弱的顺序是___________。
(4)W →香豆素-3-羧酸的化学方程式是______________________。
(5)关于有机物F下列说法正确的是__________。
a.存在顺反异构 b.分子中不含醛基
c.能发生加成、水解、氧化等反应 d. 1mol F 与足量的溴水反应,最多消耗 4 molBr2
(6)某兴趣小组将 4-羟基扁桃酸进行如下操作
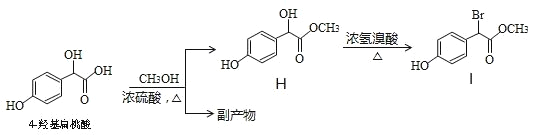
①1molH在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为______mol.
②符合下列条件的 I 的同分异构体(不考虑立体异构)为______种。
a.属于一元羧酸类化合物
b.苯环上只有 2 个取代基,其中一个是羟基
③副产物有多种,其中一种是由 2 分子 4-羟基扁桃酸生成的含有 3 个六元环的化合物,该分子中不同化学环境的氢原子有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
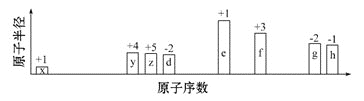
根据判断出的元素回答问题:
(1)f在周期表中的位置是____________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:__________________。
(4)写出e的单质在足量d2中燃烧后的产物与y的高价氧化物反应的化学方程式:______。
(5)写出由x、y、z、d四种元素构成的离子化合物的化学式(写一种)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下8种化合物中,不能通过化合反应直接生成的有
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Cu2(OH)2CO3 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 ⑧Na2O2
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是:( )
①N2→NO2②NO2→NO ③NH3→NO
④NH3→NO2⑤Cu→Cu(NO3)2⑥HNO3→NO2
A.①⑥B.②⑤C.④⑤D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计如图工艺流程制取硫酸铁铵。
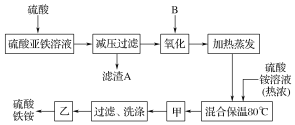
请回答下列问题:
(1)硫酸亚铁溶液加硫酸酸化的主要目的是________。
(2)下列物质中最适合的氧化剂B是________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是_____。
(4)上述流程中,氧化之后和加热蒸发之前,需加入少量______(填化学式),检验Fe2+是否已全部被氧化的方法为_______________。
(5)称取14.00 g所得产品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份溶液中加入足量NaOH溶液,过滤、洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba(NO3)2的溶液,恰好完全反应,则该硫酸铁铵的化学式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com