
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
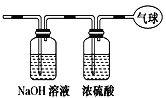
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
【答案】C
【解析】
根据混合气体的质量和在标准状况下的体积,列方程组解出其中所含CO和CO2物质的量,结合物质的性质和相关公式分析作答。
14.4 g CO和CO2的混合气体在标准状况下所占的体积约为8.96 L,则28g/moln(CO)+44g/moln(CO2)=14.4g,n(CO)+n(CO2)=![]() =0.4mol,解得n(CO)=0.2mol,n(CO2)=0.2mol;
=0.4mol,解得n(CO)=0.2mol,n(CO2)=0.2mol;
A.原混合气体所含氧原子物质的量为0.2mol+0.2mol×2=0.6mol,所含O原子数为0.6NA,A正确;
B.NaOH溶液将CO2吸收,浓硫酸干燥CO,最终气球中收集到0.2molCO,在标准状况下的体积为0.2mol×22.4L/mol=4.48L,B正确;
C.原混合气体总物质的量为0.4mol,混合气体的平均摩尔质量为![]() =36g/mol,C错误;
=36g/mol,C错误;
D.原混合气体中CO与CO2的体积之比,等于CO与CO2物质的量之比,为1:1,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
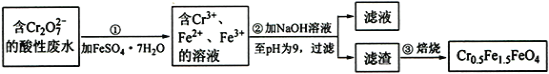
(1)第①步反应的离子方程式是_____。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe3+与Fe2+的比例为___。在第②步过程中,须持续通入N2,原因是____________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____。
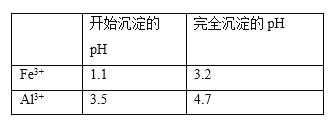
(5)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,________得到CaC12·2H2O。(在横线上补全实验步骤,实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。有关离子开始沉淀及沉淀完全时的pH见下表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 molO2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
A. 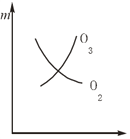 B.
B. 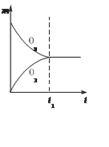
C. 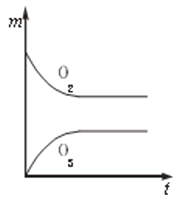 D.
D. 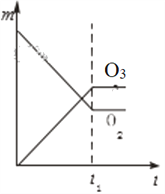
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是实验室制取和收集氨气的装置图。回答下列问题:
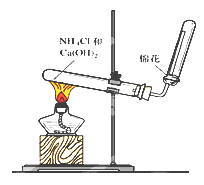
(1)写出实验室制取氨气的化学方程式__________________
(2)图中用于加热的仪器名称是___________该实验发生装置中的试管口略低于试管底的原因是____________________
(3)用蘸有浓盐酸的玻璃棒靠近收集氨气的试管管口,当观察到_____________现象时,可证明氨气已收集满。
(4)用_______________试剂干燥氨气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
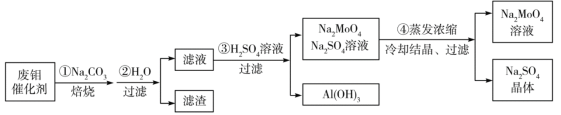
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A. 向含等物质的量的![]() 的溶液中缓慢通入氯气:
的溶液中缓慢通入氯气:![]()
B. 向含等物质的量的![]() 的溶液中缓慢加入锌粉:
的溶液中缓慢加入锌粉:![]()
C. 在含等物质的量的![]() 的混合溶液中缓慢通入CO2:
的混合溶液中缓慢通入CO2:![]() 、
、![]()
D. 在含等物质的量的![]() 的溶液中逐滴加入盐酸:
的溶液中逐滴加入盐酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。
(1)1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被_______(填“氧化”或“还原”)
(2)贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是_____________________。
(3)泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是__________________。
(4)盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是_____________。
(5)1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是___________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
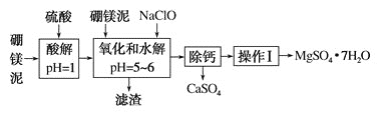
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com