
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
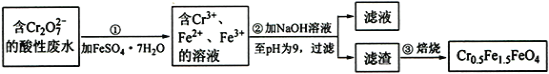
(1)第①步反应的离子方程式是_____。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe3+与Fe2+的比例为___。在第②步过程中,须持续通入N2,原因是____________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____。
(5)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,________得到CaC12·2H2O。(在横线上补全实验步骤,实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。有关离子开始沉淀及沉淀完全时的pH见下表
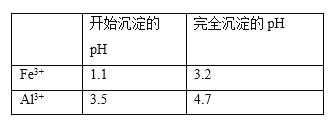
【答案】Cr2O72-+6Fe2++14H+=2 Cr3++6 Fe3++7H2O Fe(OH)3 Fe(OH)2 3:2 防止Fe2+被空气中的氧气氧化 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2 先加入足量的双氧水把Fe2+全部氧化为Fe3+,再加入氢氧化钙并搅拌,用pH计调节溶液的pH为4.7,过滤,向得到的滤液中加盐酸酸化后,蒸发浓缩,冷却结晶,过滤,用冰水洗涤,干燥后即得到CaC12·2H2O。
【解析】
(1)第①步反应是含Cr2O72-的酸性废水与绿矾反应,Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,据此写出反应的离子方程式;
(2)含Cr3+、Fe2+、Fe3+的溶液与氢氧化钠反应生成Cr(OH)3、Fe(OH)3、Fe(OH)2,据此进行分析;
(3)根据磁性材料Cr0.5Fe1.5FeO4分子组成可知,Fe2+与Fe3+的比例为x:y,则根据化合物各元素化合价代数和为0得:x+y=2.5,0.5×3+2x+3y-2×4=0,解得x、y,进而计算出①步反应后所得溶液中Fe2+与Fe3+的比例;在第②步过程中,在N2气氛围下,Fe2+不易被氧化;
(4)含FeCO3的浊液长时间暴露在空气中,会有部分固体表面变为红褐色Fe(OH)3,据此写出反应的化学方程式;
(5)将工业碳酸钙溶于盐酸,加入双氧水,把Fe2+氧化为Fe3+,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤,对滤液进行一系列操作可以得到CaCl2·2H2O。
(1)第①步反应是含Cr2O72-的酸性废水与绿矾反应,Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
故答案是:Cr2O72-+6Fe2++14H+=2Cr3++6 Fe3++7H2O;
(2)含Cr3+、Fe2+、Fe3+的溶液与氢氧化钠反应生成Cr(OH)3、Fe(OH)3、Fe(OH)2,故第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有Fe(OH)3和Fe(OH)2;
故答案是:Fe(OH)3 和Fe(OH)2;
(3)根据磁性材料Cr0.5Fe1.5FeO4分子组成可知,Fe2+与Fe3+的比例为x:y,则根据化合物各元素化合价代数和为0得:x+y=2.5,0.5×3+2x+3y-2×4=0,解得x=1,y=1.5,故为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe2+与Fe3+的比例为1:1.5=2:3;在第②步过程中,须持续通入N2,原因是N2气氛下,防止Fe2+被氧化;
故答案是:3:2;防止Fe2+被空气中的氧气氧化;
(4)含FeCO3的浊液长时间暴露在空气中,会有部分固体表面变为红褐色Fe(OH)3,反应的化学方程式为:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2;
故答案是:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2;
(5)将工业碳酸钙溶于盐酸,加入双氧水,把Fe2+氧化为Fe3+,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤,除去氢氧化铝和氢氧化铁沉淀;向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥得到CaCl2·2H2O;
故答案是:先加入足量的双氧水把Fe2+全部氧化为Fe3+,再加入氢氧化钙并搅拌,用pH计调节溶液的pH为4.7,过滤,向得到的滤液中加盐酸酸化后,蒸发浓缩,冷却结晶,过滤,用冰水洗涤,干燥后即得到CaC12·2H2O。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是()
A.2g氢气中的原子数为NA
B.1mol/LCaCl2溶液中Cl- 数为2NA
C.标准状况下22.4LCO2中原子数为3NA
D.2L2mol/LC2H5OH溶液中分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A. 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2
B. 使用高效催化剂可有效增大正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是
A. NaOH(aq) ![]() Cu(OH)2悬浊液
Cu(OH)2悬浊液![]() Cu2O
Cu2O
B. NH3![]() NO
NO![]() HNO3
HNO3
C. MgC12(aq)![]() 无水MgC12
无水MgC12![]() Mg
Mg
D. CaCl2(aq)![]() CaCO3
CaCO3![]() CaO
CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物A、B、C、D、E、F间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应,在相同条件下,F蒸气密度是氦气的22倍。
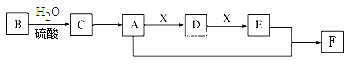
(1)B的分子式为_________________ ;F的结构简式为__________________。
(2)E中官能团的名称___________________________。
(3)A的同分异构体的结构简式_____________________。
(4)A→D反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6 mol CO2和8 mol H2,发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
测得n(H2)随时间变化如曲线Ⅰ所示。下列说法正确的是
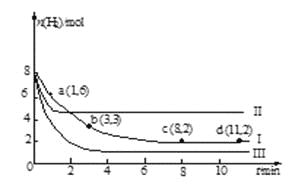
A. 该反应在0~8 min内CO2的平均反应速率是0.375mol·L-1·min-1
B. 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20%
C. 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
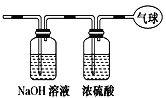
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com