
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为________________反应一段时间后负极的质量_________(填“增重”或“减少”或“不变”)
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,该电池极的负电极反应式是:_____________________;正极电极反应式_______________

(3)将铝片和铜片用导线相连,分别插入浓硝酸中(a组)和插入烧碱溶液中(b组),都形成了原电池,在a组原电池中,负极材料为___________;写出b组插入烧碱溶液中形成原电池的负极反应式:_________________________。
【答案】Pb+SO42-–2e-=PbSO4 增重 CH4+10OH-–8e-=CO32—+7H2O 4H2O + 2O2 + 8eˉ = 8OH— Cu Al+4OH-–3e-=AlO2-+2H2O
【解析】
本题要根据原电池的工作原理分析,负极失去电子,发生氧化反应,正极得到电子,发生还原反应。燃料电池是将燃料的化学能转化为电能,本质也是原电池。在书写电极反应式时可将化学反应式拆成氧化反应和还原反应两个半反应来写。
(1)因为原电池的负极发生氧化反应,分析原电池反应Pb+PbO2+2H2SO4=2PbSO4+2H2O可知,铅元素化合价由0价(Pb)升高到+2价(PbSO4),发生氧化反应,所以负极电极反应式:Pb-2e-+SO42-=PbSO4,因为PbSO4难溶于水,生成的PbSO4在负极板上析出,负极质量增加;
(2)由甲烷燃料电池原理示意图可知,CH4通入的一极产生了CO32-,碳元素的化合价由-4价升高到+4价,发生氧化反应,即CH4通入的一极是负极,考虑到电解质溶液是强碱溶液,再根据电荷守恒和原子守恒可写出负极反应式为:CH4-8e-+10OH-=CO32-+7H2O。正极显然是O2通入的一极,正极电极反应式为:O2+4e-+2H2O=4OH-;
(3)常温下浓硝酸能使铝的表面形成致密的氧化物薄膜,阻止了浓硝酸继续氧化铝,将铝片和铜片插入浓硝酸中,铝变得稳定,而铜能被浓硝酸持续氧化,所以铜为负极;常温下铝与烧碱溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,该反应中铝被氧化,所以铝为负极,负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应:
① 2C(s)+O2(g)=2CO(g) △H1 = –221 kJ/mol
② CO(g)+1/2O2(g)=CO2 (g) △H2 = –283 kJ/mol
③ 稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H3 = –57.3 kJ/mol
请回答下列问题:
(1)碳(C)的燃烧热为_______________________ 。已知碳的两种同素异形体的转化如下:C(s,金刚石) = C(s,石墨) △H = –1.9 kJ/mol ,则从能量角度判断:稳定性更大的是_________________(填名称)
(2)写出能表达反应③意义的一个热化学方程式_________________________________________________,向2L 0.5mol/L的NaOH溶液中加入稀醋酸,恰好完全反应时的热效应为△H4 ,则△H3_________△H4(填“>”,“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A. 在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN-
B. c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、![]() 、
、![]()
C. 加水稀释时![]() 值增大的溶液中可大量存在:
值增大的溶液中可大量存在: ![]() 、
、![]() 、
、![]() 、
、![]()
D. 在碱性溶液中可以大量存在: ![]() 、AlO2-、
、AlO2-、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水水资源的利用和海水化学资源的开发利用具有非常广阔的前景。
(1)列举海水淡化的两种方法:______________、______________。
(2)采用“空气吹出法”从浓海水吹出Br2,用SO2吸收,则发生反应的离子方程式为:____。
还可以用纯碱吸收,主要反应是Br2+Na2CO3+H2O → NaBr+NaBrO3+NaHCO3,当吸收1 mol Br2时,转移电子的物质的量为________mol。
(3)按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法正确的是________。
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合所得溶液中,c(NH4+)=c(Cl-)则溶液显__________(填"酸""碱"或"中")性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=__________;
(2)25℃,H2SO3![]() HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
(3)高炉炼铁中发生的反应有:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0
①该反应的平衡常数表达式K=__________;
②已知1100℃时,K=0.25,则平衡时CO的转化率为__________;
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则此时反应速率v正__________(填">""<"或"=")v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
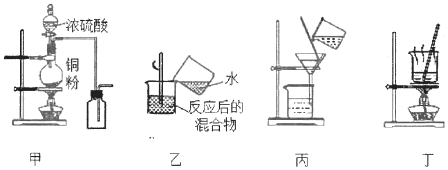
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. NaCl的摩尔质量是58.5g
B. 在1L水中溶解5.85gNaCl,即可配制得0.1mol/L的NaCl溶液
C. 标准状况下,22.4L H2O含有氢原子的数目为2NA
D. 17g NH3中含有分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
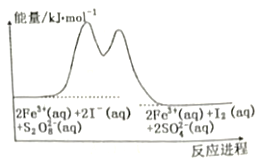
A. 化学反应速率与Fe3+浓度的大小有关
B. 该反应为吸热反应
C. Fe2+是该反应的催化剂
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com