
乙酰水杨酸俗称阿司匹林(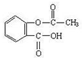 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:


制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |


 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。 (1)水浴加热(2分)
(2)防止醋酸酐和水反应(2分)
(3)除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗(2分)
(4)①防止暴沸(2分)②a(2分)③便于调控加热温度,防止乙酰水杨酸分解(2分)
(4)84.3%(或84.6%)(2分)
解析试题分析:(1)控制温度在85℃~90℃,小于100℃,应使用水浴加热;
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是乙酸酐容易发生水解,所以答案是防止醋酸酐和水反应;
(3)洗涤晶体,除去表面的杂质,用冷水,目的是减小阿司匹林的溶解,所以答案是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗;
(4)①沸石的作用是防止暴沸;
②为使冷凝管内的不蒸气得到充分冷却,在进行冷却时,应使水的方向和气流的方向相反,使水充满整个冷凝管,所以冷凝水的流进方向是a;
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解;
(4))(水杨酸)=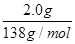 =0.0145mol,n(醋酸酐)=
=0.0145mol,n(醋酸酐)=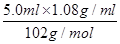 =0.053mol,
=0.053mol,
则理论上生成乙酰水杨酸0.0145mol,产率为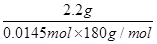 ×100%=84.3%。
×100%=84.3%。
考点:考查有机物合成的方案设计与评价。


科目:高中化学 来源: 题型:实验题
银氨溶液可用于检测CO气体。实验室研究该反应的装置图如下: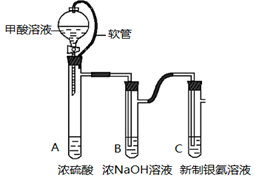
(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有 (填“氧化性”或脱水性)。
(2)软管的作用是 。
(3)浓NaOH溶液的作用是 。
(4)反应结束后试管C底部有黑色沉淀,为验证产物,分离出上层清液和底部黑色固体,并进行实验。
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
d.将黑色沉淀用蒸馏水洗净。
① 实验c的目的是 。
② 根据上述实验现象证明上层清液中含有 。
③ 已知银可溶于浓硝酸,设计实验证明黑色固体是Ag单质:
④ CO与银氨溶液反应中有氨气生成,根据实验现象写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下: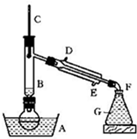
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。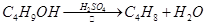
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g·cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤 b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案探究反应原理并验证产物。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________;
猜测2:白色不溶物可能为MgCO3;
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收 集到的气体点燃 | 能安静燃烧、产 生淡蓝色火焰 | 气体成分为 __①__ |
| 实验Ⅲ | 取实验Ⅰ中的白 色不溶物,洗涤, 加入足量__②__ | __③__ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄 清液,向其中加入 少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在__④__ |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
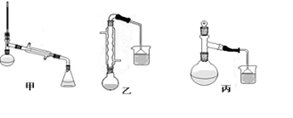
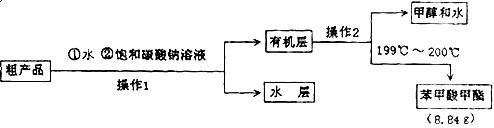
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下: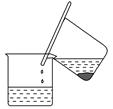
图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。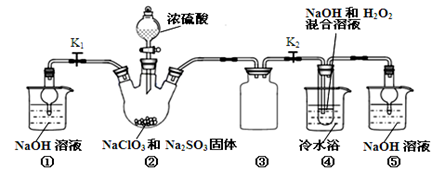
完成下列填空:
(1)装置②中产生ClO2的化学方程式为 。装置③的作用是 。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。配制待测液需用到的定量玻璃仪器是 ;
(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为 。
(5)通过分析说明装置①在本实验中的作用 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com