
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
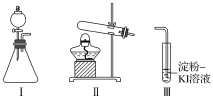
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
【答案】MnO2固体 分液漏斗 O2+4I-+4H+=2I2+2H2O 酸性环境 使用不同浓度的稀硫酸作对比实验 AD
【解析】
(1)根据装置甲的特点,用过氧化氢与二氧化锰反应制取氧气;
(2)根据丙的实验现象,在酸性条件下氧气与碘离子反应生成碘单质和水;
(3)对比乙、丙实验可知,不同之处为是否加入硫酸;为探究酸的浓度对反应速率的影响,使用不同浓度的稀硫酸做对比实验;
(4)白雾中含有H2O2、O2,均具有氧化性,据此判断。
(1)根据装置甲的特点,用过氧化氢与二氧化锰反应制取氧气,则在锥形瓶中加入二氧化锰固体,在分液漏斗中加入30%H2O2溶液;
(2)根据丙的实验现象,在酸性条件下氧气与碘离子反应生成碘单质和水,反应的离子方程式为O2+4I-+4H+=2I2+2H2O;
(3)对比乙、丙实验可知,不同之处为是否加入硫酸,则反应适宜条件为酸性;为探究酸的浓度对反应速率的影响,使用不同浓度的稀硫酸做对比实验;
(4)白雾中含有H2O2、O2,均具有氧化性。
A.白雾遇到酸性KMnO4只与H2O2反应,现象为高锰酸钾溶液褪色,可验证含有H2O2,A正确;
B.白雾与FeC12 混合时,氧气也能使亚铁离子生成铁离子,不能验证是否含有H2O2,B错误;
C.白雾与Na2S混合时,氧气也能使硫离子生成单质硫,不能验证是否含有H2O2,C错误;
D.白雾与品红混合时,只有过氧化氢使品红溶液褪色,可验证存在H2O2,D正确;
答案为AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是 ( )
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B. 中和pH、体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C. pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为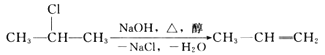
下面是几种有机化合物的转化关系:
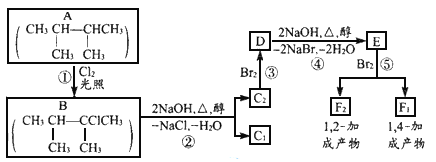
(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C1的结构简式是______________,F1的结构简式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=___kJ·mol-1(用含a、b的代数式表示);
(2)已知2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1molSO2(g)氧化为1molSO3放出99kJ的热量,请回答下列问题:
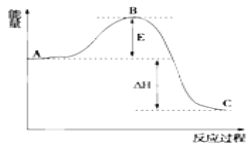
①图中A分别表示____;
②E的大小对该反应的反应热____(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“升高”“降低”)。
Ⅱ.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(3)有机物M经过太阳光光照可转化成N,转化过程如图:
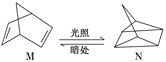 ΔH=+88.6 kJ/mol
ΔH=+88.6 kJ/mol
则M、N相比,较稳定的是___。
(4)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a__238.6(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: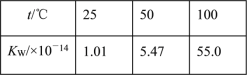
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
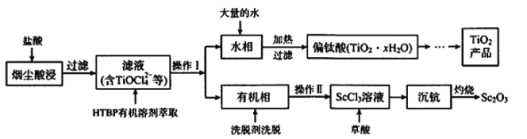
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为_____。
(2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式_____。
(3)酸浸过程中,稍过量的盐酸的作用除溶解吸收烟尘外,另外还有的作用是_______。
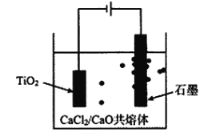
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com