
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,pH均为5的盐酸、氯化铵溶液中,水的电离程度相同 |
| C、8NH3(g)+6NO(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、对于乙酸乙酯的水解反应(△H>0),加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均增大 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:

| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6:3:2 |
| B、1:2:3 |
| C、3:2:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )
一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )| A、d是ClO3- |
| B、b→a+c反应的活化能为60kJ?mol-1 |
| C、a,b,c,d中c最稳定 |
| D、b→a+c反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于10mL |
| B、小于10mL |
| C、大于10mL |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,
有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
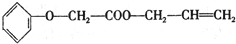 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com