

| 0.3 |
| 4 |


科目:高中化学 来源: 题型:
| A、人们在过渡元素中寻找工业催化剂和耐高温、耐腐蚀的合金材料 |
| B、糖类和油脂都能水解 |
| C、重金属盐中毒者可喝大量牛奶解毒 |
| D、煤的燃烧经过脱硫处理,可减少酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0△S>0 |
| B、氨气分解反应 2NH3?N2+3H2 达到平衡后,升高温度平衡逆向移动 |
| C、铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,pH均为5的盐酸、氯化铵溶液中,水的电离程度相同 |
| C、8NH3(g)+6NO(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、对于乙酸乙酯的水解反应(△H>0),加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 NaCl溶液 |
B、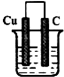 HCl溶液 |
C、 CuSO4溶液 |
D、 蔗糖溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体的判断依据:构成晶体的微粒是原子 |
| B、离子化合物的判断依据:熔融状态下能导电的化合物 |
| C、分子具有极性的判断依据:分子含极性共价键 |
| D、氧化还原反应的判断依据:反应中有电子转移或电子对偏移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体中,共价键的键能越大,熔、沸点越高 |
| B、分子晶体中,共价键的键能越大,熔、沸点越高 |
| C、存在自由电子的晶体一定是金属晶体,存在阳离子的晶体一定是离子晶体 |
| D、离子晶体中可能存在共价键,分子晶体中可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-═CH3COO-+H2O | ||
| C、苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2OC6H5OH+CO32- | ||
D、甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com