
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-═CH3COO-+H2O | ||
| C、苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2OC6H5OH+CO32- | ||
D、甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-
|
| △ |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性条件下,用H2O2将I-转化为I2:H2O2+2I-═I2+2OH- |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、氨水溶解氯化银固体:AgCl+2 NH3?H2O═[Ag(NH3)2]++Cl-+2H2O |
| D、用饱和纯碱溶液洗涤试管中残留的苯酚:CO32-+2C6H5OH→2C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
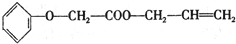 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )| A、T°C时,该反应的平衡常数值为4 |
| B、c点没有达到平衡,此时反应向逆向进行 |
| C、若c点为平衡点,则此时容器内的温度高于T°C |
| D、T°C时,直线cd上的点均为平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| B、把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol?L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 |
| C、将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol |
D、 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com