
【题目】氟及其化合物用途十分广泛,回答下列问题
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序的独特晶体,可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为_____。
(3)[H2F] + [SbF6] -(氟锑酸)是一种超强酸,其阳离子的空间构型为_____,与[H2F] +具有相同空间构型和键合形式的分子和阴离子分别是 ____。(各举一例)
(4)SF6中含____个σ键,根据____ 理论,可判断出其空间构型为正八面体,其中S的杂化方式为_____。
(5)SF6被广泛用于高压电器设备的绝缘介质。其键能可通过类似于Born-Haber循环能量构建能量图a计算键能。则F-F键的键能为_____kJ·mol-1 。

(6)CuCl 熔点为 426℃,熔化时几乎不导电;CuF 的熔点是 908℃,密度为 7.1g·cm-3 。
①CuF的熔点比CuCl高的原因是_____。
②已知NA为阿伏伽德罗常数的值,立方CuF晶胞结构如图b,则CuF的晶胞参数a= ____nm。(列出计算式即可)
【答案】X射线衍射(XRD) ![]() V型
V型 ![]() 和
和![]() 6 价层电子对互斥理论(VSEPR)
6 价层电子对互斥理论(VSEPR) ![]() 155
155 ![]() 是分子晶体,分子晶体的熔沸点一般低于离子晶体
是分子晶体,分子晶体的熔沸点一般低于离子晶体 
【解析】
(1)从外观上无法直接区分晶体、准晶体和非晶体,因此只能用X射线衍射(XRD)的方法来鉴别三者;
(2)铜是29号元素,注意其![]() 的特殊排布;
的特殊排布;
(3)我们可以使用价层电子对互斥理论判断空间构型,用替代法来书写等电子体;
(4)氟原子最外层有7个电子,因此还需要成一个键来达到8电子稳定结构,则![]() 中一共有6个
中一共有6个![]() 键,据此来分析即可;
键,据此来分析即可;
(5)键能的定义是在标准状况下,将1mol气态分子解离为气态原子所需的能量,根据图示来计算即可;
(6)这是一道典型的晶体计算题,晶胞内有4个纯黑的球,因此一个晶胞含4个![]() ,再来列式计算即可。
,再来列式计算即可。
(1)在X射线的照射下,晶体会出现明锐的衍射图案,非晶体因为没有规律的晶格结构,因此不会产生衍射图案,而准晶体的衍射图案介于二者之间;
(2)铜原子的核电荷数29,1s22S22p63s23p63d104s1或[Ar] 3d104s1;铜原子的价电子排布的轨道式为![]() ;
;
(3)![]() 离子中氟原子的孤电子对数
离子中氟原子的孤电子对数![]() ,
,![]() 键电子对数为2,价层电子对数为4,VSEPR模型为四面体,空间构型为V型;与
键电子对数为2,价层电子对数为4,VSEPR模型为四面体,空间构型为V型;与![]() 具有相同空间构型和键合形式的分子有
具有相同空间构型和键合形式的分子有![]() 、
、![]() ,阴离子有
,阴离子有![]() ;
;
(4)根据分析,![]() 分子中一共有6个
分子中一共有6个![]() 键,根据价层电子对互斥理论可以判断其空间构型为正八面体,而硫原子一共形成了6个杂化轨道,而硫原子中只有M层有d轨道,因此为
键,根据价层电子对互斥理论可以判断其空间构型为正八面体,而硫原子一共形成了6个杂化轨道,而硫原子中只有M层有d轨道,因此为![]() 杂化;
杂化;
(5)由图a可知![]() ,则
,则![]() 键的键能为
键的键能为![]() ;
;
(6)①从![]() 熔融时几乎不导电可以判断它是一个分子晶体,而分子晶体一般熔沸点较低,低于离子晶体和原子晶体;
熔融时几乎不导电可以判断它是一个分子晶体,而分子晶体一般熔沸点较低,低于离子晶体和原子晶体;
②根据分析,晶胞中一共有4个![]() ,则单个晶胞的质量为
,则单个晶胞的质量为![]() ,代入密度的表达式得到其晶胞体积
,代入密度的表达式得到其晶胞体积![]() ,1cm=107nm,所以则晶胞参数
,1cm=107nm,所以则晶胞参数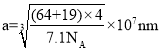 。
。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )

A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C.原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种
D.d点溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 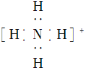 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
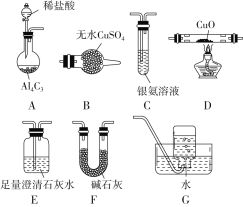
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
(查阅资料)
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3;
②Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为__________________________。
(2)按气流方向各装置从左到右的连接顺序为A→_____________________。
(3)实验中滴加稀盐酸的操作是_________________________。
(4)已知气体产物中含有CO,则装置C中可能观察到的现象是___________________________;装置F的作用为____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______;
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量的0.1 mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需要增加对比实验,完成表中内容。
实验步骤(不要求写出具体的操作过程) | 预期现象与结论 |
________________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
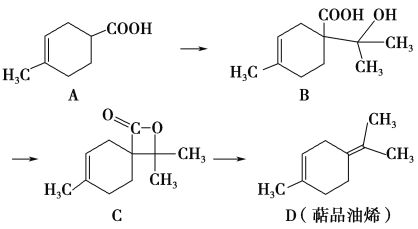
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是______________________;
(2)(CH3CH2)2C(CH3)2的名称为___________________;
(3)2-甲基-1-丁烯的键线式__________________________;
(4)相对分子质量最小的有机物分子式_________,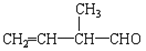 所含官能团的名称是________________;
所含官能团的名称是________________;
(5)3-甲基戊烷的一氯代产物有___________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”“摩尔”和“摩尔质量”的叙述中正确的是( )
A.物质的摩尔质量就是其相对分子(原子)质量
B.“摩尔”是国际单位制中的一个物理量
C.0.012 kg 12C中所含的碳原子数为NA
D.1 mol任何物质都含有约6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
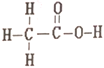 和
和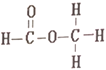
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用黄铜矿[主要成分CuFeS2,还含少量锌(Zn)、铅(Pb)的硫化物]冶炼铜的一种方法的流程如下:

(1)过程Ⅰ中发生下列反应:①CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S;②CuCl + Cl-![]() CuCl2-上述反应中盐酸的作用是________________________。
CuCl2-上述反应中盐酸的作用是________________________。
(2)过程Ⅱ中通入空气,将Fe2+转化FeOOH沉淀,离子方程式是_________________。
(3)Ⅳ中加入Na2CO3溶液的目的是______________________________________。
(4)Ⅴ中反应的离子方程式是______________________________。
(5)秉承绿色化学的理念,请提出在冶炼厂中处理和利用副产品NaCl溶液的方案,并说明理由:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com