
【题目】按要求填空
(1)羟基的电子式是______________________;
(2)(CH3CH2)2C(CH3)2的名称为___________________;
(3)2-甲基-1-丁烯的键线式__________________________;
(4)相对分子质量最小的有机物分子式_________,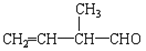 所含官能团的名称是________________;
所含官能团的名称是________________;
(5)3-甲基戊烷的一氯代产物有___________种(不考虑立体异构)。
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为_____。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC![]() 的立体构型为________(用文字描述)。
的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________,电子式为__________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
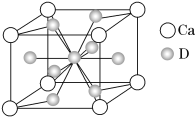
(5)镍元素的原子价电子排布式为_____________________.
镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________________(填数值);氢在合金中的密度为_____________。(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——有机化学基础)
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:![]()
(1)能与银氨溶液反应的B的同分异构体的结构简式为_________________,
(2)D的结构简式为____________,①的反应类型为_____________,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及___________,
(4)由F和G生成H的反应方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
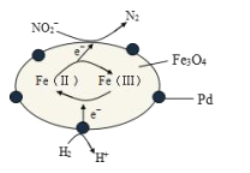
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途十分广泛,回答下列问题
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序的独特晶体,可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为_____。
(3)[H2F] + [SbF6] -(氟锑酸)是一种超强酸,其阳离子的空间构型为_____,与[H2F] +具有相同空间构型和键合形式的分子和阴离子分别是 ____。(各举一例)
(4)SF6中含____个σ键,根据____ 理论,可判断出其空间构型为正八面体,其中S的杂化方式为_____。
(5)SF6被广泛用于高压电器设备的绝缘介质。其键能可通过类似于Born-Haber循环能量构建能量图a计算键能。则F-F键的键能为_____kJ·mol-1 。

(6)CuCl 熔点为 426℃,熔化时几乎不导电;CuF 的熔点是 908℃,密度为 7.1g·cm-3 。
①CuF的熔点比CuCl高的原因是_____。
②已知NA为阿伏伽德罗常数的值,立方CuF晶胞结构如图b,则CuF的晶胞参数a= ____nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
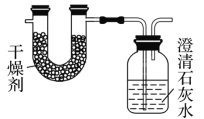
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是产生雾霾的主要因素,对废气的综合治理是当前“打赢蓝天保卫战”的重要举措。

(1)利用某些催化剂,可实现将空气中的碳氧化物和氮氧化物转化为无毒的大气可循环物质。
已知:①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol-1
②2C(s)+O2(g)2CO(g)△H2=-221.0kJmol-1
③C(s)+O2(g)CO2(g)△H3=-393.5kJmol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=______kJmol-1;某温度下,反应①、②、③的平衡常数分别为K1、K2、K3表示,则该反应的平衡常数K=______(用K1、K2、K3表示)。
(2)在同温同压下,一定量的NO和CO在不同催化剂条件下反应的能量变化如图所示。当反应进行相同的时间时,测得催化剂______(填“1”或“2”)条件下NO转化率更高,其原因是______。

(3)一定温度下,向体积为1L的密闭容器中充入NO和CO的混合气体2mol,在催化剂作用下发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),达到平衡时,NO、CO的转化率及N2的体积分数为![]() 的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。

(4)利用如图所示的电解装置能将NO变废为宝,其中a、b为惰性电极。电极a的电极反应式为______。每转移3mol电子,溶液中通过质子交换膜的离子的物质的量是______mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)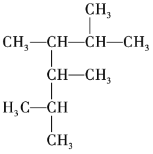 的名称为______。
的名称为______。
(2) 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pt-g-C3N4光催化氧化法脱除NO的过程如图所示。该脱除过程中,下列说法不正确的是

A.该脱除过程中太阳能转化为化学能。
B.在Pt端发生的是氧化反应
C.过程①发生的反应为H2O2 - 2e-=O2↑+ 2H+
D.过程③的化学方程式2NO2 + H2O2= 2HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com