
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
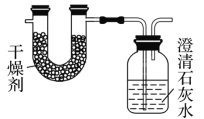
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。
【答案】1.8 5 0.6 3∶1 CH4O CH3OH
【解析】
已知某醇燃料含有碳、氢、氧三种元素,故其完全燃烧产物为CO2和H2O,U型管中增加的质量是水的质量,NaOH溶液中增加的质量是二氧化碳的质量,根据C、H元素守恒,即可计算两者的质量比,该燃料分子中C、H的原子个数比为,N(C):N(H)=![]() ∶
∶![]() = 1:4。据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍。
= 1:4。据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍。
⑴U型管中增加的水的质量m(H2O)=102.9g101.1g=1.8g;NaOH溶液中增加的二氧化碳的质量m(CO2)=314.2g312g=2.2g,CO2 + Ca(OH)2 = CaCO3↓+ H2O,得到碳酸钙沉淀质量![]() ;故答案为:1.8;5。
;故答案为:1.8;5。
⑵m(C)=m(CO2)×![]() =2.2g×
=2.2g×![]() =0.6g,故生成的二氧化碳中碳元素的质量为0.6g;故答案为:0.6。
=0.6g,故生成的二氧化碳中碳元素的质量为0.6g;故答案为:0.6。
⑶m(H)=m(H2O)×![]() =1.8g×
=1.8g×![]() =0.2g,故生成的水中氢元素的质量为0.2g;m(C):m(H)=0.6g:0.2g=3:1,故该燃料中碳元素与氢元素的质量比为3:1;故答案为:3:1。
=0.2g,故生成的水中氢元素的质量为0.2g;m(C):m(H)=0.6g:0.2g=3:1,故该燃料中碳元素与氢元素的质量比为3:1;故答案为:3:1。
⑷该燃料分子中C、H的原子个数比为N(C):N(H)= ![]() ∶
∶![]() =1:4,据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1:4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该物质的分子式为CH4O,结构简式为CH3OH;故答案为:CH4O;CH3OH。
=1:4,据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1:4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该物质的分子式为CH4O,结构简式为CH3OH;故答案为:CH4O;CH3OH。


科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
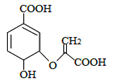
A.分子中含有2种官能团
B.可分别与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3mol NaOH发生中和反应
D.可使溴水、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
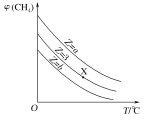
A.该反应的焓变ΔH<0
B.图中Z的大小为a<3<b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g)![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g)![]() C(s)+CO2(g) △H=-17kJ/mol
C(s)+CO2(g) △H=-17kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
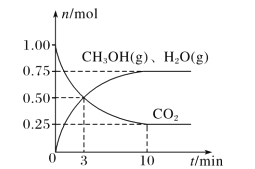
①从反应开始到平衡,氢气的平均反应速率v(H2)= ____。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
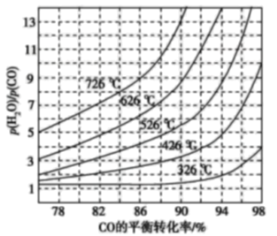
①上述反应的正反应方向是 ____(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是 _______,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是 ____(填字母)。
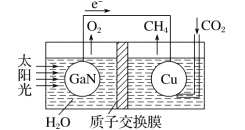
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是______________________;
(2)(CH3CH2)2C(CH3)2的名称为___________________;
(3)2-甲基-1-丁烯的键线式__________________________;
(4)相对分子质量最小的有机物分子式_________,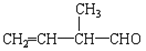 所含官能团的名称是________________;
所含官能团的名称是________________;
(5)3-甲基戊烷的一氯代产物有___________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,该溶液中氯离子的物质的量浓度为( )
A.0.5 mol·L-1B.2 mol·L-1
C.2.5 mol·L-1D.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、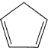 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
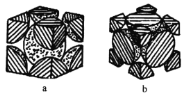
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物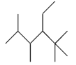 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com