
【题目】Ⅰ.已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如图所示.(部分生成物和反应条件已略去)
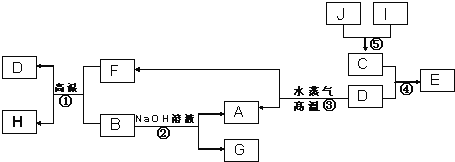
请回答下列问题:
(1)写出组成物质D的元素在周期表中的位置:_________________。
(2)写出反应②的化学方程式:___________________。
(3) J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________。
Ⅱ.某无色溶液,其中可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
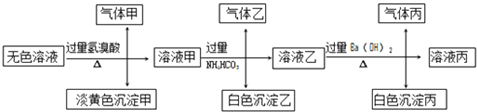
回答下列问题:
(4)生成沉淀甲的离子方程式:__________________;
(5)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | |||
2 | |||
3 | |||
4 |
(6)针对溶液中可能存在的离子,用实验验证其是否存在的方法是_______________。
【答案】
(1)第四周期第Ⅷ族;
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(4)2S2-+SO32-+6H+=3S↓+3H2O;
(5)检验SO2、除尽SO2、检验CO2(其它合理答案也给分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | 检验SO2 | 品红溶液 | 红色退去 |
2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(6)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)
【解析】
试题分析:I的浓溶液具有还原性,应为HCl,J是一种黑色固体,可与浓盐酸反应,应为MnO2,二者反应生成C为Cl2,D为常见金属,可与水蒸气反应,应为Fe,则E为FeCl3,A为H2,F为Fe3O4,B能与Fe3O4在高温下反应,且能与NaOH溶液反应,则B为Al,G为NaAlO2,H为Al2O3,
(1)D为Fe,位于周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH- +2H2O = 2AlO2- +3H2↑,故答案为:2Al+2OH- +2H2O = 2AlO2- +3H2↑;
(3)根据题意可知反应的离子方程式为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,故答案为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;
(4)Ag+与题目所给的所以阴离子都能反应,不能大量共存,所以原溶液不含Ag+,所以淡黄色沉淀甲不是AgBr,为SO32与S2在酸性条件下反应生成的S单质沉淀,所以离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32和SO32反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在,故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
步骤 | 实验目的 | 试剂 | 现象 |
1 | 检验SO2 | 品红溶液 | 红色褪去 |
2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(5)因为Ba2+、Al3+不能与CO32、SO32共存,所以加入NH4HCO3后产生白色沉淀,说明原溶液含有AlO2-,加入过量氢溴酸后,转化为Al3+,Al3+与HCO3反应生成Al(OH)3沉淀,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
(6)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,故答案为:取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:A(s)+B(g)═2D(g)△H>0.该反应达到平衡后,下列条件的改变有利于平衡向正反应方向移动的是( )
A. 升高温度和减小压强 B. 降低温度和减小压强
C. 降低温度和增大压强 D. 升高温度和增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)=CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
![]()
由此计算△H1=kJ.mol-1,
已知:△H2=-58kJ.mol-1,则△H3=kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为____________(填曲线标记字母),其判断理由是____________。
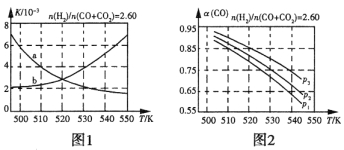
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而_____________(填“增大”或“减小”),其原因是_____________。图2中的压强由大到小为___________,其判断理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g)![]() 2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
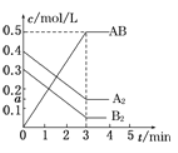
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞内元素和化合物的叙述,错误的是
A. 组成细胞干重中含量最多的化学元素是碳
B. 磷是磷脂、ATP、DNA等化合物的组成元素,是组成生物体的大量元素
C. 线粒体、叶绿体和核糖体中都能产生水
D. 在细胞的一生中,细胞中的自由水/结合水的值逐渐上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年是门捷列夫诞辰180周年,下列事实不能用元素周期律解释的有( )
A.碱性:KOH>NaOH
B.溶解度:SO2>CO2
C.酸性:HClO4>H2SO4
D.气态氢化物的稳定性:H2O>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. XX化妆品从纯天然植物中提取,不含任何化学物质
B. 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐
C. 氢氧燃料电池、硅太阳能电池中都利用了原电池原理
D. 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com