
【题目】X、Y、Z、M、W是前四周期元素,原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y的原子半径是在同周期中最大;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子己全充满,最外层只有2个电子。
请回答下列问题:
(1)Y元素在周期表中的位置是_________; W2+离子的价电子排布式为__________。
(2)X能与S、氮、氧二种元素构成化合物XO(NH2)2,其中X原子和N原子的杂化方式为分别为_____、____,该化合物分子中的π键与![]() 键的个数之比是____;该物质易溶于水的主要原因是____。
键的个数之比是____;该物质易溶于水的主要原因是____。
(3)己知Be和A1元素处于周期表中对角线位置,化学性质相似,请写出Y元素的最高价氧化物对应水化物与Be相互反应的化学方程式:____________。
(4)M晶体的原子堆积如图所示,则该晶体的堆积方式为________,晶体中M原子的配位数是_____。某M配合物的化学式是[M(H2O)5C1]Cl2·H2O,1mol该配合物中含配位键是_____mol。

(5)Y离子和Z离子比较,半径较大的是__________(填离子符号)元素Y与元素Z形成了晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最接近的Y离子有__________个。

【答案】第三周期IA族 3d10 sp2 sp3 1:7 CO(NH2)2能与水分子间形成氢键 Be+2NaOH =Na2BeO2+H2↑ 六方最密堆积(或ABABAB 堆积) 12 6 S2- 6
【解析】
X、Y、Z、W是元素周期表前四周期中常见的元素,X元素原子最外层电子数是内层的2倍,则X为C元素;Y的原子半径是在同周期中最大,则Y为Na元素;Z元素原子的最外层电子数比次外层电子数少2个,原子只能有3个电子层,最外层电子数为6,故Z为S元素;M原子外围电子排布式为3dn4sn,由于4s能级最大容纳2个电子,且3d能级容纳电子,故n=2,则M为Ti;W的内层电子已全充满,最外层只有2个电子,原子序数大于硫,只能处于第四周期,原子核外电子数为2+8+18+2=30,故W为Zn,据此解答。
根据上述分析可知:X、Y、Z、M、W分别是C、Na、S、Ti和Zn,则
(1)Y为Na元素,C原子核外有3个电子层、最外层有1个电子,所以处于周期表中第三周期IA族,Zn2+离子的外围电子排布式为3d10,
故答案为:第三周期IA族;3d10;
(2)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,分子中C与O形成C=O双键,C原子与N原子形成CN单键,N原子与H原子之间形成NH单键,分子中C原子成3个σ键,没有孤电子对,故C原子采取sp2杂化,N原子成3个σ键、有1对孤电子对,故N原子采取sp3杂化,该化合物分子中有1个π键、7个σ键,π键与σ键数目之比为1:7,CO(NH2)2能与水分子间形成氢键,该物质易溶于水,
故答案为:sp2;sp3;1:7;CO(NH2)2能与水分子间形成氢键;
(3) Y元素的最高价氧化物对应水化物为氢氧化钠,依据铝与氢氧化钠溶液反应的原理可知Be与氢氧化钠溶液反应生成Na2BeO2和氢气,其化学方程式为:Be+2NaOH =Na2BeO2+H2↑;
(4)根据M晶体的原子堆积方式示意图可知,其堆积方式为六方密堆积(或ABABAB堆积),以轴线原子研究,层内有6个原子相邻、上、下两层各有3个原子与之相邻,故配位数为12;M为Ti,某M配合物化学式是[Ti(H2O)5Cl]Cl2H2O,在该配合物中,配位数为6,因此1mol该配合物中含配位键是6mol,故答案为:六方密堆积(或ABABAB堆积);12;6;
(5)S2-比Na+多一个电子层,故半径较大的是S2-;Na2S晶体中Na+与S2-的个数比为2:1,根据晶胞结构可以看出,顶点与面心的小灰球代表S2-,晶胞内含8×![]() +6×
+6×![]() =4,晶胞体内所含的黑球代表Na+,晶胞内个数为8,分别位于八分之一晶胞的小立方的体心,故每个Na+周围与他最接近的Na+有6个,故答案为:S2-;6。
=4,晶胞体内所含的黑球代表Na+,晶胞内个数为8,分别位于八分之一晶胞的小立方的体心,故每个Na+周围与他最接近的Na+有6个,故答案为:S2-;6。


科目:高中化学 来源: 题型:
【题目】某学生用邻苯二甲酸氢钾,(分子式为![]() 相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:________。
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂_____(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________。
(3)该实验要用到的主要玻璃仪器_______、______。
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
实验 编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_____
a.滴定时有NaOH溶液滴到锥形瓶外面;
b.未用NaOH溶液润洗滴定管;
c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定;
d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视;
e.酚酞指示剂由无色变为红色时立即停止滴定。
(5)NaOH溶液的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)用系统命名法命名下列物质或者根据名称写出对应的结构简式
 _____________
_____________
CH3CH(CH3)CH2CH(CH3)CH(CH3)CH3 ____________
3,4,4-三甲基-1-戊炔_________
(2)指出下列物质中的官能团

甲________ 乙_______ 丙__________
(3)C4H8Cl2的同分异构体有________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势,有望取代锂离子电池。最近,山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaxFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
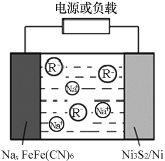
A.充电时,Na+被还原为金属钠
B.充电时,阴极反应式:xNa++FeIIFeIII(CN)6xe![]() NaxFeIIFeIII(CN)6
NaxFeIIFeIII(CN)6
C.放电时,NaxFeIIFeIII(CN)6为正极
D.放电时,Na+移向Ni3S2/Ni电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2+O2![]() 2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1B.SO2为0.3 mol·L-1
C.SO3为0.4 mol·L-1D.SO2、SO3均为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
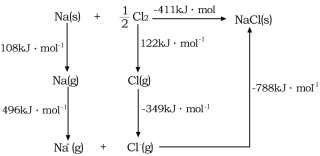
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
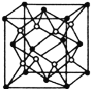
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列4种有机化合物
A:CH2=CH2 B:![]() C:CH3COOH D:
C:CH3COOH D: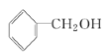
(1)写出化合物A、C中官能团的名称________、_______;
(2)4种化合物中能使溴的四氯化碳溶液褪色的是____(写名称);反应的化学方程为:_____;具有特殊气味、常做有机溶剂的是_____(写名称)。
(3)4种化合物中能与NaOH发生中和反应的是_____(写名称)。
(4)C与D在浓硫酸存在下,加热时生成的有机物的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)d原子的基态原子电子排布式为____________
(2)晶体d、晶体da、晶体ac2的熔点由高到低的顺序为__________ (用化学式表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________,bc3-离子的空间构型为____________。
(4)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为_________g·cm-3。(用含NA、r的表达式表示)
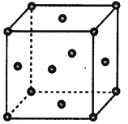
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com