
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
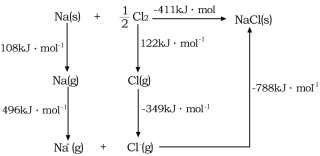
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
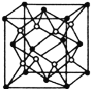
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
【答案】![]() 球 BC 乙炔钠是离子晶体,
球 BC 乙炔钠是离子晶体,![]() 是分子晶体 直线形
是分子晶体 直线形 ![]()
![]()
![]() 349 788
349 788 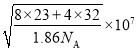
【解析】
(1)基态S原子是16号原子,它的价电子轨道表示式为![]() ;Na的最高能级为3s能级,电子云模型为球形;
;Na的最高能级为3s能级,电子云模型为球形;
(2)乙炔钠是一种有机金属化合物,结构中存在离子键、σ键和π键,乙炔钠的熔沸点比S8高,原因是乙炔钠是离子晶体,S8是分子晶体;
(3)根据VSEPR模型计算,中心原子不存在孤电子对,因此N3-为直线型分子,中心N原子的杂化方式为sp杂化;
(4)根据Born—Haber循环可以得到,Na原子的电子电离能为气态基态电中性原子失去电子所吸收的能量为496 kJ·mol-1,Cl-Cl的键能为1molCl2断开化学键所吸收的能量为244 kJ·mol-1,Cl的电子亲和能为Cl-得到电子变成Cl所放出的能量为349 kJ·mol-1,NaCl的晶格能为Na+和Cl-形成稳定氧化物所放出的能量为788 kJ·mol-1;
(5)从晶胞结构中可以看出Na在晶胞的体心,S在晶胞的顶点和面心上,一个晶胞中4个Na2S,由此可以算出晶胞参数为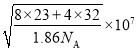 。
。


科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如图:
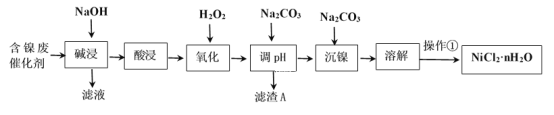
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Al的原子结构示意图为___。
(2)“酸浸”、“溶解”所使用的酸为___。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至___为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.68LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗溶液NaOH的体积是( )
A.60mLB.45mLC.30mLD.15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体徤康,化合物H是一种临床治疗高血脂症的药物。H的结构简式如图所示。
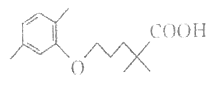
下列说法不正确的是( )
A. 有机物H含有的官能团只有羧基
B. 1mol H完全燃烧消耗19molO2
C. 有机物H是芳香化合物
D. 有机物H能和钠、碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是前四周期元素,原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y的原子半径是在同周期中最大;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子己全充满,最外层只有2个电子。
请回答下列问题:
(1)Y元素在周期表中的位置是_________; W2+离子的价电子排布式为__________。
(2)X能与S、氮、氧二种元素构成化合物XO(NH2)2,其中X原子和N原子的杂化方式为分别为_____、____,该化合物分子中的π键与![]() 键的个数之比是____;该物质易溶于水的主要原因是____。
键的个数之比是____;该物质易溶于水的主要原因是____。
(3)己知Be和A1元素处于周期表中对角线位置,化学性质相似,请写出Y元素的最高价氧化物对应水化物与Be相互反应的化学方程式:____________。
(4)M晶体的原子堆积如图所示,则该晶体的堆积方式为________,晶体中M原子的配位数是_____。某M配合物的化学式是[M(H2O)5C1]Cl2·H2O,1mol该配合物中含配位键是_____mol。

(5)Y离子和Z离子比较,半径较大的是__________(填离子符号)元素Y与元素Z形成了晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最接近的Y离子有__________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧产物为CO、CO2和水蒸气,此混合气体重49.6g,当其缓慢通过无水CaCl2时,CaCl2增重25.2g,则原混合气体中CO的质量为( )
A.11.2gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
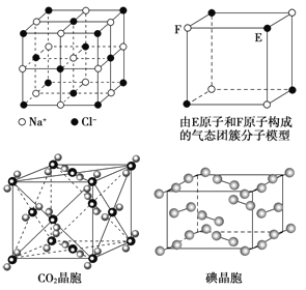
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 每个该气态团簇分子的分子中含有1/2个E原子
C. 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D. 在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目正确的是
A.C4H10属于烷烃的同分异构体有3种
B.分子组成是C5H10O2属于羧酸的同分异构体有5种
C.分子组成是C5H10O属于醛的同分异构体有3种
D.![]() 的一溴代物有5种
的一溴代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现据“三大酸”与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解,该反应的离子方程式为_。
(2)在一定体积的18mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol,则浓硫酸的实际体积__(填“大于”“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可向其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为__。
(3)根据如图操作及现象推断酸X为__(填序号)。

A.浓盐酸 B.浓硫酸 C.浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com