
【题目】有关晶体的结构如图所示,下列说法中不正确的是
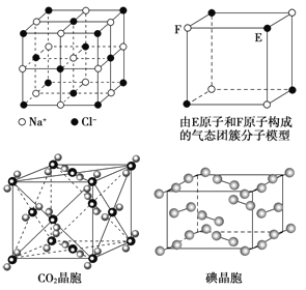
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 每个该气态团簇分子的分子中含有1/2个E原子
C. 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D. 在碘晶体中,碘分子的排列有两种不同的方向
【答案】B
【解析】
A.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A正确;
B.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故B错误;
C.根据CO2晶胞结构图可知,经顶点上的CO2分子为例,每个CO2分子周围距离最近的CO2分子分布在结经过这个顶点的各个面的面心上,这样的面共有12个,所以一个CO2分子周围有12个CO2分子紧邻,故C正确;
D.根据晶胞结构图可知,碘为分子晶体,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故D正确;
答案:B


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势,有望取代锂离子电池。最近,山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaxFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
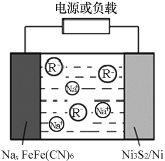
A.充电时,Na+被还原为金属钠
B.充电时,阴极反应式:xNa++FeIIFeIII(CN)6xe![]() NaxFeIIFeIII(CN)6
NaxFeIIFeIII(CN)6
C.放电时,NaxFeIIFeIII(CN)6为正极
D.放电时,Na+移向Ni3S2/Ni电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
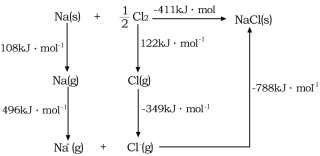
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
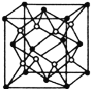
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列4种有机化合物
A:CH2=CH2 B:![]() C:CH3COOH D:
C:CH3COOH D: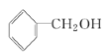
(1)写出化合物A、C中官能团的名称________、_______;
(2)4种化合物中能使溴的四氯化碳溶液褪色的是____(写名称);反应的化学方程为:_____;具有特殊气味、常做有机溶剂的是_____(写名称)。
(3)4种化合物中能与NaOH发生中和反应的是_____(写名称)。
(4)C与D在浓硫酸存在下,加热时生成的有机物的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A(如下图所示),短周期元素 X、Y、Z原子序数依次增大,其 中 Z位于第三周期。Z与 Y2可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于 X、Y、Z的叙述,正确的是
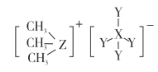
A.离子半径:Y >Z
B.氢化物的稳定性:X >Y
C.最高价氧化物对应水化物的酸性:X >Z
D.化合物 A中,X、Y、Z最外层都达到 8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
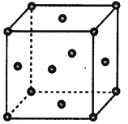
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)d原子的基态原子电子排布式为____________
(2)晶体d、晶体da、晶体ac2的熔点由高到低的顺序为__________ (用化学式表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________,bc3-离子的空间构型为____________。
(4)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为_________g·cm-3。(用含NA、r的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切联系。下列物质用途不正确的是( )
A.Fe2(SO4)3具有氧化性,可对饮用水杀菌消毒
B.Fe2O3为红色粉末,可用于制备红色涂料
C.Cu2O为红色粉末,可用于制备深色玻璃
D.CuSO4和熟石灰可配制农药﹣波尔多液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com