
【题目】向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是
A. NaCl、I2 B. NaCl、NaBr C. NaBr、I2 D. NaCl
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:Ⅰ.在废液中加入过量铁粉,过滤;
Ⅱ.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ.合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ.…,得到FeCl36H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 .
(2)试剂A是 .
(3)步骤Ⅲ中发生的离子方程式为 .
(4)完成步骤Ⅳ需要用到的实验装置是(填字母).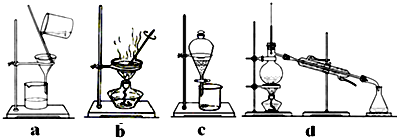
(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液①用托盘天平称FeCl36H2O晶体,其质量是g.
②实验时下图所示操作的先后顺序为(填编号).
蒸馏水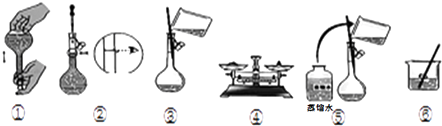
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚甲基丙烯酸羟乙酯的结构简式为  ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯
(3)由乙烯制备乙二醇 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】XeO3是一种不稳定的物质,具有强氧化性.
(1)配平反应的离子方程式:
XeO3+Mn2++H2O→MnO4﹣+Xe↑+H+
(2)反应现象为:①有气泡产生;② .
(3)被氧化的元素是 .
(4)将适量的XeO3投入30mL 0.1molL﹣1 Mn2+的水溶液中,刚好完全反应.
①此时转移电子总数为 .
②将反应后的溶液稀释至90mL,所得溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是(填序号).
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2 , 则转移电子的物质的量为mol.
(2)目前已开发出用电解法制取ClO2的新工艺. 
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: .
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol;用平衡移动原理解释阴极区pH增大的原因 .
(3)ClO2对污水中Fe2+、Mn2+、S2﹣和CN﹣等有明显的去除效果.某工厂污水中含CN﹣ a mg/L,现用ClO2将CN﹣氧化,只生成两种气体,其离子反应方程式为;处理100m3这种污水,至少需要ClO2mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.
(1)①中反应的化学方程式是 , 其中铜发生了(填“氧化”或“还原”)反应,判断依据为 .
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,④中溶液褪色.想要立即终止铜与硫酸的反应,最恰当的方法是 . a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
加入试剂 | 现象 | 反应的离子方程式 | |
第一份 | 加入NaOH溶液 | 有白色沉淀生成 | |
第二份 | 加入氯水 | 有白色沉淀生成 |
完成上述反应的离子方程式.
(4)④中棉花团的作用是 .
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)西班牙的瑞奥汀托河是一条酸河,河水中含有硫酸亚铁和硫酸.经调查发现,这是由于上游河床含有黄铁矿(FeS2 , 铁为+2价),在水中氧的作用下,发生了反应:2FeS2+7O2+2H2O═2FeSO4+2H2SO4 . 反应中FeS2是剂,氧化产物是 , 当有1mol FeS2完全反应时,转移的电子数mol.
(2)某同学打算用稀硫酸与金属锌反应制备标准状况下的氢气224ml,为防止硫酸过量而造成浪费,实验中应需要硫酸mol.
(3)实验室现有一瓶稀硫酸如图A所示,B为空瓶,若利用A瓶中的稀硫酸配制B瓶上标签所示稀硫酸240ml,需要准备的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和 , 所需A瓶中稀硫酸的体积 . 在配制溶液时若实验遇到下列情况,会造成所配硫酸溶液的物质的量浓度偏低的操作是(填序号) . 
①稀释的硫酸转移到容量瓶中后未洗涤烧杯
②趁热将溶液注入容量瓶中并定容
③摇匀后发现液面低于刻度线于是又加水
④容量瓶中原有少量蒸馏水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com