
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1- 、Br-、CrO42- B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42- D.Br- 、CrO42-、C1-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:实验题
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol/L的MgCl2溶液中各加入10滴2 mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol/L NH4Cl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL蒸馏水 | 沉淀不溶解 |
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2: 。
(3)为验证猜想,又设计了以下实验
序号 | 实验内容 | 结 果 |
1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
①用醋酸铵溶液与氢氧化镁反应的原因是 。
②实验证明猜想正确的是 (填“1”或“2”)。
(4)实验Ⅱ观察到沉淀不溶解。该实验的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
根据反应式:①2Fe3++2I- 2Fe2++I2 和② Br2+2Fe2+
2Fe2++I2 和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(18分)依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池,如图所示。请回答下列问题:

(1)电极X的材料是________;电解质溶液Y是________溶液。(填名称)
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为____________________________。
(3)外电路中的电子是从________极流向______极(填电极材料)。外电路中每通过0.1 mol电子,银电极的质量理论上增加 g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向 电极。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,下列判断不正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,下列判断不正确的是
A.c1∶c2 =1∶3
B.平衡时,Y和Z生成速率之比为3∶2
C.X、Y的转化率不相等
D.c1的取值范围为0< c1< 0.14 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸。同时向a中加入少量CuSO4溶液。图中产生H2的体积V L与时间t min的关系正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:填空题
【化学---选修3:物质结构与性质(15分)】“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过 相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为 (填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为 。
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
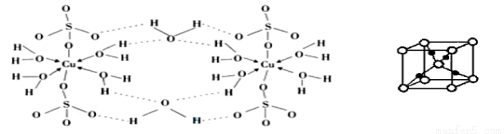
①写出基态Cu2+的核外电子排布式 。
②胆矾中含有的粒子间作用力是 (填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中键的数目为 。胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =
B.物质的量浓度c(HA) =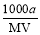 mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(14分)我国某地利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:

(1)操作a的名称是 。制硫酸工艺中净化SO2窑气的目的是 。
(2)装置B中生成两种酸式盐,它们的化学式分别是 。
(3)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是 。(选填字母)
A.NaOH溶液、酚酞试液 B.氨水、酚酞试液
C.碘水、淀粉溶液 D.KMnO4溶液、稀H2SO4液
(4)SO2可转化为硫酸盐。现有一种硫酸盐的化学式为Fe2(SO4)3·x(NH4)2SO4·yH2O。现称取该复盐2.410g,加入过量的NaOH溶液并加热,生成的气体用100mL 0.0500 mol·L―1硫酸吸收,多余的硫酸用0.2000 mol·L―1的NaOH溶液滴定,消耗NaOH溶液25.00mL。再将等质量的复盐溶于水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀2.330g。试列出计算过程确定该复盐的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com