
【题目】某无色溶滚中加入金属铝有氢气放出,则在此溶液中一定能大量共存的离子是
A. K+、Na+、Cl-、HCO3- B.K+、NH4+、Cl-、CO32-
C. K+、Fe2+、NO3-、SO42- D. K+、Na+、NO3-、SO42-
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )
A.含有离子键
B.属于原子晶体
C.既有离子键又有共价键
D.属于离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100 mL 0.2 mol·L-1蔗糖溶液中所含分子总数为0. 02 NA
B. 40 mL 10 mol·L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1 NA
C. 标准状况下,22.4 L CHCl3中含有的氯原子数目为3 NA
D. 14 g CO和N2混合气体中含有的电子总数为7 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2-溴丙烷为原料制取1,2-丙二醇(HOCH2-CHOH-CH3),需要经过下列哪几步反应( )
A. 消去-取代-加成B. 取代-消去-加成
C. 消去-加成-水解D. 水解-取代-取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是( )
A. 常温常压下测得1molN2的质量为28g
B. 用量筒测得排水法收集制得的氢气体积为50.28mL
C. 将洗净的锥形瓶和容量瓶放入烘箱中烘干
D. 用托盘天平称取2.50g胆矾,受热充分失水后,固体质量减轻0.90g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3,其中FeSO4为反应物.则该反应中的还原产物为
A.Fe(NO3)3 B. HNO3 C. Fe2(SO4)3 D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂方法正确的是
A. 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B. 除去FeCl3中少量CuCl2:加入足量铁粉,过滤
C. 除去NaHCO3溶液中的Na2CO3:通入过量CO2充分反应
D. 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
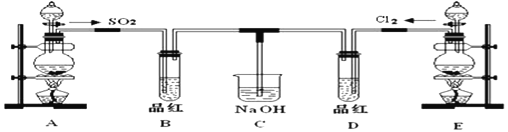
(1)实验室用装置E制备Cl2,离子方程式为__________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: B:______________,D:_________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:____________,D:_________________。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品。工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇。
(1)若碳的燃烧热为393.5kJ·mol-1,氢气的燃烧热为285.8kJ·mol-1。已知反应
C(s)+2H2O(g) ![]() CO2(g)+2H2(g) △H>0,能否求出该反应的△H_______(填“能”或“不能”)。若能则求出其△H(若不能请说明理由):_____________________。
CO2(g)+2H2(g) △H>0,能否求出该反应的△H_______(填“能”或“不能”)。若能则求出其△H(若不能请说明理由):_____________________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是____________、____________(填两点)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。
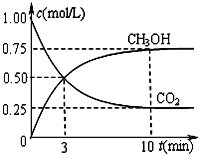
i.用H2表示0-3min内该反应的平均反应速率______________。
ii.该温度下的平衡常数为__________________。10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),此时V正 _________V逆(填“>”、“<”或“=”)。
iii.对于基元反应aA+bB![]() cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为V正=k正·c(A)a·c(B)b ;逆反应速率为V逆=k逆·c(C)c·c(D)d,其中k正、k逆为速率常数。若将上述反应视为基元反应则在上述条件下k逆∶k正=_________。反应进行到第3 min时V正 :V逆 =________。
cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为V正=k正·c(A)a·c(B)b ;逆反应速率为V逆=k逆·c(C)c·c(D)d,其中k正、k逆为速率常数。若将上述反应视为基元反应则在上述条件下k逆∶k正=_________。反应进行到第3 min时V正 :V逆 =________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com