
����Ŀ��ȼú�����ĸĽ��������ں�����������ЧӦ��������Ⱦ�����ܽ�����Դ�����ã��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ����ҵ����ú��ˮΪԭ��ͨ��һϵ��ת����Ϊ�����Դ������ҵԭ�ϼ״���
��1����̼��ȼ����Ϊ393.5kJ��mol-1��������ȼ����Ϊ285.8kJ��mol-1����֪��Ӧ
C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ��H��0���ܷ�����÷�Ӧ�ġ�H_______����ܡ����ܡ�����������������H����������˵�����ɣ���_____________________��
CO2(g)+2H2(g) ��H��0���ܷ�����÷�Ӧ�ġ�H_______����ܡ����ܡ�����������������H����������˵�����ɣ���_____________________��
��2����ҵ��Ҳ����������������Ӧ�õ���CO2��H2��һ���ϳɼ״�����Ӧ����ʽΪ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g�� ��H��0
CH3OH(g)��H2O(g�� ��H��0
�ٹ�ҵ����������CO2��H2��ת����________���ǰ�ߴ������ߴ���һ�������жϡ�����Ϊ����״��IJ��ʿ��Բ�ȡ�Ĵ�ʩ��____________��____________�������㣩��
����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
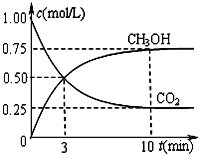
i����H2��ʾ0-3min�ڸ÷�Ӧ��ƽ����Ӧ����______________��
ii�����¶��µ�ƽ�ⳣ��Ϊ__________________��10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ʱV�� _________V�������������������������
iii�����ڻ�Ԫ��ӦaA+bB![]() cC+dD���ԣ���ijһʱ�̵�˲ʱ���ʼ��㹫ʽ���£�����Ӧ����ΪV��=k����c(A)a��c(B)b ���淴Ӧ����ΪV��=k����c(C)c��c(D)d������k����k��Ϊ���ʳ���������������Ӧ��Ϊ��Ԫ��Ӧ��������������k����k��=_________����Ӧ���е���3 minʱV�� ��V�� ��________��
cC+dD���ԣ���ijһʱ�̵�˲ʱ���ʼ��㹫ʽ���£�����Ӧ����ΪV��=k����c(A)a��c(B)b ���淴Ӧ����ΪV��=k����c(C)c��c(D)d������k����k��Ϊ���ʳ���������������Ӧ��Ϊ��Ԫ��Ӧ��������������k����k��=_________����Ӧ���е���3 minʱV�� ��V�� ��________��
���𰸡� ���� ������Ӧ������ȼ���ȵķ�Ӧ��ˮ��״̬��ͬ��H2O(g)![]() H2O(l) ��Hδ֪ ���ߴ� �����¶� ����ѹǿ���������δ�������2�֣���һ����1�֣������𰸲��÷֣� 0.5mol��L-1��min-1 5.3mol-2��L-2��
H2O(l) ��Hδ֪ ���ߴ� �����¶� ����ѹǿ���������δ�������2�֣���һ����1�֣������𰸲��÷֣� 0.5mol��L-1��min-1 5.3mol-2��L-2��![]() mol-2��L-2 V����V�� 3�U16��
mol-2��L-2 V����V�� 3�U16��![]() 36
36
����������1�����ڷ�Ӧ�������ʵľۼ�״̬�йأ��ۼ�״̬��ͬ����Ӧ�Ȳ�ͬ��������Ӧ������ȼ���ȵķ�Ӧ��ˮ��״̬��ͬ�����Բ������������Ӧ���ʱ䣻��C��s��+2H2O��g��![]() CO2��g��+2H2��g����H��0���ɶ�����̼�����������ʵ���֮��Ϊ1��2����
CO2��g��+2H2��g����H��0���ɶ�����̼�����������ʵ���֮��Ϊ1��2����
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H��0��������̼���������ʵ���֮��Ϊ1��3���൱�����������̼Ũ�ȣ�����������ת���ʴ��ڶ�����̼ת���ʣ�CO2��g��+3H2��g��
CH3OH��g��+H2O��g����H��0��������̼���������ʵ���֮��Ϊ1��3���൱�����������̼Ũ�ȣ�����������ת���ʴ��ڶ�����̼ת���ʣ�CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H��0Ϊ���������С�ġ����ȷ�Ӧ��Ҫ����״��IJ��ʿ��Բ�ȡ�Ĵ�ʩ�ǽ����¶ȡ�����ѹǿʹƽ���������ƶ����ڢ���3minʱ���ɼ״���0.5mol/L�����ݷ���ʽ��֪����������1.5mol/L��������H2��ʾ0��3min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ1.5mol/L��3min��0.5mol��L-1��min-1��ii��ƽ��ʱ�״�Ϊ0.75mol/L��������̼Ϊ0.25mol/L����
CH3OH��g��+H2O��g����H��0Ϊ���������С�ġ����ȷ�Ӧ��Ҫ����״��IJ��ʿ��Բ�ȡ�Ĵ�ʩ�ǽ����¶ȡ�����ѹǿʹƽ���������ƶ����ڢ���3minʱ���ɼ״���0.5mol/L�����ݷ���ʽ��֪����������1.5mol/L��������H2��ʾ0��3min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ1.5mol/L��3min��0.5mol��L-1��min-1��ii��ƽ��ʱ�״�Ϊ0.75mol/L��������̼Ϊ0.25mol/L����
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����1 3 0 0
�仯Ũ�ȣ�mol/L����0.75 2.25 0.75 0.75
ƽ��Ũ�ȣ�mol/L����0.25 0.75 0.75 0.75
��ƽ�ⳣ��K==0.75��0.75/0.25��0.753=16/3=5.33�������¶Ȳ��䣬����ܱ��������ٳ���1mol CO2��g����1mol H2O��g������ʱŨ���أ�0.75��1.75/1.25��0.753��2.5��5.33�����������ƶ�����V����V����iii��ƽ��ʱ����V��=V����v��=k��c��A��ac��B��b��V��=k��c��C��cc��D��d����k����k��=c(CH3OH)��c(H2O)/c(CO2)��c3(H2)=K=3��16��
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����1 3 0 0
�仯Ũ�ȣ�mol/L����0.50 1.50 0.50 0.50
3minŨ�ȣ�mol/L����0.50 1.50 0.50 0.50
v��=k��c��A��ac��B��b��V��=k��c��C��cc��D��d��V����V��= k��c(A) ac(B) b/k ��c(C) cc(D) d=(K��/K��)��(0.5��1.53/0.5��0.5)=36��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�ܹ��м���������������ų������ڴ���Һ��һ���ܴ��������������
A. K+��Na+��Cl-��HCO3- B.K+��NH4+��Cl-��CO32-
C. K+��Fe2+��NO3-��SO42- D. K+��Na+��NO3-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ����������ͼ��ʾ��װ����ȡ������������ش��������⡣

(1)�Ҵ������й����ŵ�������_______��
�����еĹ����ŵĽṹ��ʽ ________��
(2)�Թ�a�м��뼸�����Ƭ��Ŀ����____________��
(3)�Թ�a�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________����Ӧ������__________��
(4)��Ӧ��ʼǰ���Թ�b��ʢ�ŵ���Һ��____________��
(5)����____________�ķ������Ƶõ������������������
(6)Ũ��������� _______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cu(OH)2]=2.2��10-20����ij����Fe3+��Cu2+����Һ�У�c(Fe3+)Ϊ4.0��10-8mol��L-1�������Һ�еμӰ�ˮ������ʼ����������������ʱ����Һ��pH����Һ�����������c(Cu2+)Ϊ
A. 10 2.2 mol��L-1 B. 4 2.2��10-1 mol��L-1
C. 4 2.2 mol��L-1 D. 10 2.2��10-1 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���101kpaʱ�����顢��Ȳ�ͱ�ϩ��ɵĻ����32mL�����������ϲ���ȫȼ�գ���ȥˮ�������ָ���ԭ�����¶Ⱥ�ѹǿ��������������С��72mL��ԭ���������Ȳ���������Ϊ
A��12��5% B��25% C��50% D��75%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����̿�ʯ��п��ʯ���������ϡ��㶫���ຣ�ȡ����̿���һ�ֳ������̿�ʯ������Ҫ�ɷ���MnO2��������Al2O3��SiO2����п����Ҫ�ɷ���ZnS��������FeS��CuS��CdS�����ʣ���������������ϵ���������̿����п��Ϊԭ���Ʊ�MnO2��Zn������������¡�

��֪����ʯ�����н���Ԫ������ҺA�о���������ʽ���ڡ�
���ֽ���������ȫ������pH���±���
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1���������MnO2��CuS�����Ṳ��ʱ�е���ɫ������������д���÷�Ӧ�Ļ�ѧ����
ʽ___________________��
��2������ڼ�����������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ���_________________��
��3���������MnO2��������________________������һ������X������__________��
A��ZnO B��MgO �ã�Cu2(OH)2CO3 D��MnCO3
��4������ӵ�ص����������ж��֣�����MnO2��Li����LiMnO2��һ�ֳ������������ϡ���ط�Ӧ����ʽΪ��Li1-xMnO2+LixC6=LiMnO2+6C��д��������ӵ�ص������缫��Ӧʽ_____________________��
��֪��HCN�ĵ��볣��K=4.9��10��10��H2S�ĵ��볣��K1=1.3��10��7��K2=7.0��10��15��
��NaCN��Һ��ͨ��������H2S���壬��Ӧ�����ӷ���ʽΪ_______________________��
�ڷ�ˮ���������г���H2S��Mn2+ת��ΪMnS��ȥ������0.020 mol��L��1 Mn2+��ˮ
��ͨ��һ������H2S���壬������Һ��pH=a����HS��Ũ��Ϊ1.0��10�D4 mol��L��1ʱ��Mn2+��ʼ��������a=________��[��֪��Ksp(MnS)=1.4��10��15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z���ֶ�����Ԫ�ص�������֮��Ϊ11����X��Y��Z���γɻ�����X2YZ3�������ж���ȷ����
A. X��Y��Z������Ϊͬ����Ԫ��
B. ������X2YZ3����������ˮ
C. Y��ԭ�Ӱ뾶һ����ZС
D. X����λ�ڵ�IIA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д�������л���Ľṹ��ʽ������ݽṹ��ʽд�����ƣ���
��1��2��6��������4���һ����飺________________________________��
��2��2��5��������2��4����ϩ��________________________________��
��3��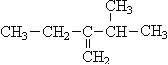 ________________________________��
________________________________��
��1��һ��̬������һ��̬ϩ����ɻ�����干10g�����������ܶ�����ͬ������������12.5�����û������ͨ����ˮʱ����ˮ����8. 4 g �������������Ϊ_____________��
���������������ϩ���������Ϊ_________��
��2����ϩ����������干amol����bmol����������һ�ܱ������У���ȼ���ַ�Ӧ����ϩ�ͱ���ȫ�������꣬�õ�CO��CO2�Ļ�������54gˮ������a��ȡֵ��Χ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��B��C��D��E֮�䷢�����µ�ת����
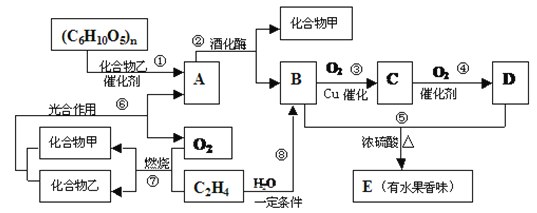
��1��д��C���ʵĽṹ��ʽ��__________��
��2�������ڡ���ת����Ӧ�У����ڼӳɷ�Ӧ����__________�����÷�Ӧ�����д����
��3����A��ˮ��Һ�м������Ƶ�Cu��OH��2������ʱ������ʵ��������__________��
��4����д����Ӧ�Ļ�ѧ��Ӧ����ʽ��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com