
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
A.氯化硼液态时能导电而固态时不导电 B.硼原子以sp杂化
C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子属极性分子
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示:
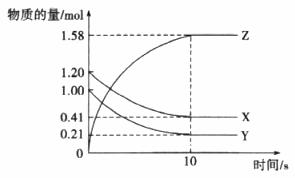
①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为 ( )
A. p区、第五周期、ⅠB族 B. ds区、第五周期、ⅠB族
C. d区、第四周期、ⅠB族 D. ds区、第五周期、Ⅷ族
查看答案和解析>>
科目:高中化学 来源: 题型:
在以离子键为主的化学键中常含有共价键的成分。下列各组原子形成化学键中共价键成分最少的是( )
A.Li,F B.Na,Cl C.Na,F D.Mg,O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如下图:则C4Si4H8的二氯代物的同分异构体数目为( )
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用下列装置进行乙醇催化氧化的实验。

⑴ 实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
__________________________________________________________________。
⑵ 甲和乙两个水浴作用不相同,乙的作用是___________________。集气瓶中收集到的气体的主要成分是_____________________。
⑶ 若试管a中收集到的液体用紫色石蕊试纸,试纸显红色,说明液体中还有____________。要除去该物质,可先在混合液中加入_________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后再通过___________(填实验操作名称)即可除去。
⑷ 实验一段时间后,将试管a中的液体取出,加入足量的银氨溶液,再放入甲烧杯中,很快出现明显的现象。写出该反应的化学方程式 ;反应类型为
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀)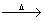 CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)生成0.5mol还原产物时,转移的电子的物质的量为 mol。
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧法是测定有机化合物化学式的一种方法,现进行如下实验:(1)将有机物A 置于氧气流中充分燃烧,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重8.8g,消耗氧气6.72 L(标准状况下)。求该物质中各元素的原子个数比。
(2)质谱仪测定有机化合物的相对分子质量为46,写出该物质的分子式。
(3)根据价键理论,预测A的可能结构,试写出所有可能的结构简式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com