
¡¾̀âÄ¿¡¿¡¾»¯Ñ§¡ªÎïÖʽṹÓëĐÔÖÊ¡¿M¡¢R¡¢X¡¢YΪÔ×ÓĐ̣ÊửÀ´ÎÔö´óµÄ¶̀ÖÜÆÚÖ÷×åÔªËØ£¬ZÊÇ̉»ÖÖ¹ư¶ÉÔªËØ¡£M»ù̀¬Ô×ÓL²ăÖĐp¹́µÀµç×ÓÊưÊÇsµç×ÓµÄ2±¶£¬RÊÇͬÖÜÆÚÔªËØÖĐ×î»îÆĂµÄ½đÊôÔªËØ£¬XºÍMĐγɵÄ̉»ÖÖ»¯ºÏÎïÊÇ̉ưÆđËáÓêµÄÖ÷̉ª´óÆøÎÛȾÎZµÄ»ù̀¬Ô×Ó4sºÍ3d¹́µÀ°ë³äÂú¡£Çë»Ø´đÏÂÁĐÎỀ⣺
£¨1£©R»ù̀¬Ô×ӵĵç×ÓÅŲ¼Ê½ÊÇ £¬XºÍYÖĐµç¸ºĐԽϴóµÄÊÇ £῭îÔªËØ·ûºÅ£©¡£
£¨2£©XµÄÇ⻯ÎïµÄ·ĐµăµÍÓÚÓëÆä×é³ÉÏàËƵÄMµÄÇ⻯ÎÆäỘ̉ÊÇ________________¡£
£¨3£©XÓëMĐγɵÄXM3·Ö×ӵĿƠ¼ä¹¹ĐÍÊÇ__________¡£
£¨4£©MºÍRËùĐγɵÄ̉»ÖÖÀë×Ó»¯ºÏÎïR2M¾§̀åµÄ¾§°ûÈçÓ̉ͼËùʾ£¬ỘͼÖĐ´óÇ̣´ú±íµÄÀë×ÓÊÇ_________£῭îÀë×Ó·ûºÅ£©¡£

£¨5£©ÔÚÏ¡Ạ́ËáÖĐ£¬ZµÄ×î¸ß¼Ûº¬ÑơËáµÄ¼ØÑΣ¨³ÈÉ«£©Ñơ»¯MµÄ̉»ÖÖÇ⻯ÎZ±»»¹ÔΪ+3¼Û£¬¸Ă·´Ó¦µÄ»¯Ñ§·½³̀ʽÊÇ_________¡£
£¨6£©Èô¾§°ûµÄÀⳤΪa cm ,ỘR2M¾§̀åµÄĂܶÈΪ=___________g¡¤cm¨C3¡£
¡¾´đ°¸¡¿£¨1£©[Ne]3s1»̣1s22s22p63s1£»Cl
£¨2£©H2O·Ö×ÓÖ®¼äÄÜĐγÉÇâ¼ü£¬¶øH2S²»ÄÜ
£¨3£©Æ½ĂæÈư½ÇĐΣ¨4£©O2-
£¨5£©3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2¡ü+7H2O+K2SO4
£¨5£©248/a3¡Á6.02¡Á1023
¡¾½âÎö¡¿
ÊỒâ·ÖÎö£º¸ù¾ỪẩâÖªM¡¢R¡¢X¡¢YΪÔ×ÓĐ̣ÊửÀ´ÎÔö´óµÄ¶̀ÖÜÆÚÖ÷×åÔªËØ£¬ZÊÇ̉»ÖÖ¹ư¶ÉÔªËØ¡£M»ù̀¬Ô×ÓL²ăp¹́µÀÊưÊÇs¹́µÀµç×ÓÊưµÄ2±¶£¬ỘMÊÇOÔªËØ£»RÊÇͬÖÜÆÚÔªËØÖĐ×î»îÆĂµÄ½đÊôÔªËØ£¬ỘRÊÇNaÔªËØ£»XºÍMĐγɵÄ̉»ÖÖ»¯ºÏÎïÊÇĐγÉËáÓêµÄÖ÷̉ª´óÆøÎÛȾÎỘXÊÇSÔªËØ£¬YΪClÔªËØ£»ZµÄ»ù̀¬Ô×Ó4sºÍ3d¹́µÀ°ë³äÂú£¬¼´¼Ûµç×ÓÅŲ¼Ê½Îª3d54s1£¬ZÊÇCrÔªËØ¡£
£¨1£©RÊÇNaÔªËØ£¬Ô×ÓĐ̣ÊưΪ11£¬¸ù¾Ư¹¹ỐÔÀíÈ·¶¨Æä»ù̀¬Ô×ӵĵç×ÓÅŲ¼Ê½Îª1s22s22p63s1»̣[Ne]3s1£»SºÍCl±È½Ïµç¸ºĐԽϴóµÄÊÇClÔªËØ¡£
£¨2£©H2SµÄ·ĐµăµÍÓÚH2OµÄÖ÷̉ªỘ̉ÊÇË®·Ö×Ó¼äĐγÉÇâ¼ü£¬Ê¹Ë®µÄ·ĐµăÉư¸ß¡£
£¨3£©SO3ÖĐẠ́Ô×ӵļ۲ăµç×Ó¶ÔΪ3+£¨6-3¡Á2£©/2=3£¬Ă»ÓĐ¹Âµç×Ó¶Ô£¬¸Ă·Ö×ӵĿƠ¼ä¹¹ĐÍΪƽĂæÈư½ÇĐΡ£
£¨4£©¸ù¾Ư¾§°û½á¹¹¿É̉ÔËă³ö°×Ç̣µÄ¸öÊưΪ![]() £½4£¬ºÚÇ̣µÄ¸öÊưΪ8¸ö£¬ÓÉÓÚƠâÖÖÀë×Ó»¯ºÏÎïµÄ»¯Ñ§Ê½ÎªNa2O£¬ºÚÇ̣´ú±íµÄÊÇNa+£¬°×Ç̣ÊÇO2-¡£
£½4£¬ºÚÇ̣µÄ¸öÊưΪ8¸ö£¬ÓÉÓÚƠâÖÖÀë×Ó»¯ºÏÎïµÄ»¯Ñ§Ê½ÎªNa2O£¬ºÚÇ̣´ú±íµÄÊÇNa+£¬°×Ç̣ÊÇO2-¡£
£¨5£©¸ù¾ỪẩâÖªÖظơËá¼Ø±»»¹ÔΪCr3+£¬Ộ¹ưÑơ»¯Çâ±»Ñơ»¯Éú³ÉÑơÆø£¬ÀûÓĂ»¯ºÏ¼ÛÉư½µ·¨Åäƽ£¬·´Ó¦µÄ»¯Ñ§·½³̀ʽΪ£ºK2Cr2O7+3H2O2+ 4H2SO4£½K2SO4+Cr2(SO4)3+3O2¡ü+7H2O¡£
£¨6£©Èô¾§°ûµÄÀⳤΪa cm£¬ỘR2M¾§̀åµÄĂܶÈΪ=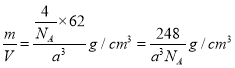 ¡£
¡£


 ǧÀïÂí×ßỊ̈¼ÙÆÚÆÚÄ©·ÂƠæÊÔ¾íº®¼ÙϵÁĐ´đ°¸
ǧÀïÂí×ßỊ̈¼ÙÆÚÆÚÄ©·ÂƠæÊÔ¾íº®¼ÙϵÁĐ´đ°¸
| Ä꼶 | ¸ßÖĐ¿Î³̀ | Ä꼶 | ³ơÖĐ¿Î³̀ |
| ¸ß̉» | ¸ß̉»Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ở» | ³ở»Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ß¶₫ | ¸ß¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ơ¶₫ | ³ơ¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ßÈư | ¸ßÈưĂâ·Ñ¿Î³̀ÍƼö£¡ | ³ơÈư | ³ơÈưĂâ·Ñ¿Î³̀ÍƼö£¡ |
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿100gÎïÖʵÄÁ¿Å¨¶ÈΪ18mol/L£¬ĂܶÈΪ¦Ñg/mLµÄŨẠ́ËáÖĐ£¬¼ÓÈë̉»¶¨Á¿µÄˮϡÊÍΪ9mol/LµÄẠ́ ËáÈÜ̉º£¬Ộ¼ÓÈëË®µÄ̀å»ưÊÇ
A£®´óÓÚ100mL B£®Đ¡ÓÚ100mL C£®µÈÓÚ100mL D£®µÈÓÚ100/¦Ñ mL
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÔÚÖ²Îï̀åÄÚ£¬×î»ù±¾µÄ»¯Ñ§ÔªËغͺ¬Á¿×î¶àµÄÔªËØ·Ö±đÊÇ
A. C¡¢O B. O¡¢H C. C¡¢ H D. H¡¢O
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿Na2SO3Ó¦ÓĂ¹ă·º¡£ÀûÓĂ¹¤̉µ·Ï¼îÔü£¨Ö÷̉ª³É·ÖNa2CO3£©ÎüÊƠẠ́Ë᳧βÆøÖеÄSO2ÖƱ¸Î̃Ë®Na2SO3µÄ³É±¾µÍ£¬ÓÅÊÆĂ÷ÏÔ£¬ÆäÁ÷³̀ÈçÏ¡£
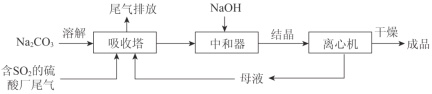
£¨1£©¾ÙÀư˵Ă÷Ị̈´óÆøÖĐÅÅ·ÅSO2µ¼ÖµĻ·¾³ÎỀ⣺_________¡£
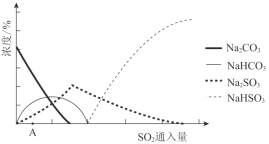
£¨2£©ÏÂͼΪÎüÊƠË₫ÖĐNa2CO3ÈÜ̉ºÓëSO2·´Ó¦¹ư³̀ÖĐÈÜ̉º×é³É±ä»¯¡£Ộ³ơÆÚ·´Ó¦£¨Í¼ÖĐAµẳÔÇ°£©µÄÀë×Ó·½³̀ʽÊÇ_________¡£
£¨3£©ÖĐºÍÆ÷ÖĐ·¢ÉúµÄÖ÷̉ª·´Ó¦µÄ»¯Ñ§·½³̀ʽÊÇ_________¡£
×ÊÁÏÏÔʾ£º ¢ñ.Na2SO3ÔÚ33¡æʱÈܽâ¶È×î´ó£¬½«Æä±¥ºÍÈÜ̉º¼ÓÈÈÖÁ33¡æ̉ÔÉÏʱ£¬ÓÉÓÚÈܽâ¶È½µµÍ»áÎö³öÎ̃Ë®Na2SO3£¬ÀäÈ´ÖÁ33¡æ̉ÔÏÂʱÎö³öNa2SO3¡¤7H2O£» ¢̣.Î̃Ë®Na2SO3ÔÚ¿ƠÆøÖĐ²»̉×±»Ñơ»¯£¬Na2SO3¡¤7H2OÔÚ¿ƠÆøÖĐ̉×±»Ñơ»¯¡£ |
£¨4£©ÎªÁ˽µµÍÓÉÖĐºÍÆ÷ËùµĂÈÜ̉ºÖĐNa2SO3µÄÈܽâ¶È£¬´Ó¶ø̀á¸ß½á¾§²úÂÊ£¬ÖĐºÍÆ÷ÖĐ¼ÓÈëµÄNaOHÊǹưÁ¿µÄ¡£
¢ÙÇë½áºÏNa2SO3µÄÈܽâƽºâ½âÊÍNaOH¹ưÁ¿µÄỘ̉_________¡£
¢Ú½á¾§Ê±Ó¦Ñ¡ÔñµÄ×î¼Ñ²Ù×÷ÊÇ_________£¨Ñ¡̀î×Öĸ£©¡£
A£®95~100¡æ¼ÓÈÈƠô·¢£¬Ö±ÖÁƠô¸É
B£®Î¬³Ö95~100¡æƠô·¢Å¨ËơÖÁÓĐ´óÁ¿¾§̀åÎö³ö
C£®95~100¡æ¼ÓÈÈŨËơ£¬ÀäÈ´ÖÁỂνᾧ
£¨5£©Îª¼́ÑéNa2SO3³ÉÆ·ÖĐÊÇ·ñº¬ÉÙÁ¿Na2SO4£¬ĐèÑ¡ÓõÄÊÔ¼ÁÊÇ_________¡¢_________¡£
£¨6£©KIO3µÎ¶¨·¨¿É²â¶¨³ÉÆ·ÖĐNa2SO3µÄº¬Á¿£ºỂÎÂϽ«0.1260g ³ÉÆ·ÈÜÓÚË®²¢¼ÓÈëµí·Û×öָʾ¼Á£¬ÔÙÓĂËáĐÔKIO3±ê×¼ÈÜ̉º£¨x mol/L£©½øĐеζ¨ÖÁÈÜ̉ºÇ¡ºĂÓÉÎ̃É«±äΪÀ¶É«£¬ÏûºÄKIO3±ê×¼ÈÜ̉º̀å»ưΪy mL¡£
¢ÙµÎ¶¨ÖƠµăÇ°·´Ó¦µÄÀë×Ó·½³̀ʽÊÇ£º![]() IO3-+
IO3-+![]() SO32- =
SO32- =![]() _______ +
_______ +![]() _______£¨½«·½³̀ʽ²¹³äÍêƠû£©¡£
_______£¨½«·½³̀ʽ²¹³äÍêƠû£©¡£
¢Ú³ÉÆ·ÖĐNa2SO3£¨M = 126 g/mol£©µÄÖÊÁ¿·ÖÊưÊÇ_________¡£
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿£¨1£©̉»¶¨Î¶ÈÏ£¬ÔÚºăÈƯĂܱƠÈƯÆ÷ÖĐN2O5¿É·¢ÉúÏÂÁĐ·´Ó¦£º2N2O5(g) ![]() 4NO2(g)£«O2(g) ¦¤H>0
4NO2(g)£«O2(g) ¦¤H>0
¢Ù·´Ó¦´ïµ½Æ½ºâºó£¬ÈôÔÙͨÈë̉»¶¨Á¿µªÆø£¬ỘN2O5µÄת»¯Âʽ«________(̀î¡°Ôö´ó¡±¡¢¡°¼ơĐ¡¡±»̣¡°²»±ä¡±)¡£
¢ÚϱíΪ·´Ó¦ÔÚT1ζÈϵIJ¿·ÖʵÑéÊư¾Ư£º
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol¡¤L£1 | 5.00 | 3.52 | 2.48 |
Ộ500 sÄÚN2O5µÄ·Ö½âËÙÂÊΪ__________¡£
¢ÛÔÚT2ζÈÏ£¬·´Ó¦1 000 sʱ²âµĂNO2µÄŨ¶ÈΪ4.98 mol¡¤L£1£¬ỘT2________T1¡£
£¨2£©ÈçͼËùʾװÖĂ¿ÉÓĂÓÚÖƱ¸N2O5£¬ỘN2O5ÔÚµç½â³ØµÄ________ÇøÉú³É£¬Æäµç¼«·´Ó¦Ê½Îª____________

²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿
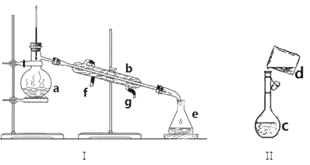
£¨1£©Đ´³öÏÂÁĐ̉ÇÆ÷µÄĂû³Æ£º
a. b. c. e.
£¨2£©ÈôÀûÓĂ×°ÖĂI·ÖÀëËÄÂÈ»¯̀¼ºÍ¾Æ¾«µÄ»́ºÏÎ»¹È±ÉÙµÄ̉ÇÆ÷ÊÇ ¡£ÀäÄưË®ÓÉ £῭îf»̣g£©¿ÚͨÈë¡£
£¨3£©ÏÖĐèÅäÖÆ0.1mol/LNaOHÈÜ̉º450mL£¬×°ÖĂIIÊÇijͬѧת̉ÆÈÜ̉ºµÄʾ̉âͼ¡£
¢ÙͼÖеĴíÎóÊÇ ¡£
¢Ú¸ù¾Ư¼ÆËăµĂÖª£¬ÓĂÍĐÅ̀̀́ƽËùĐè³ÆÁ¿NaOHµÄÖÊÁ¿Îª g¡£
¢ÛÅäÖÆʱ£¬ÆäƠưÈ·µÄ²Ù×÷˳Đ̣ÊÇ£¨ÓĂ×Öĸ±íʾ£¬Ă¿¸ö×ÖĸֻÄÜÓẲ»´Î£©________¡£
A£®ÓĂ30mLˮϴµÓÉƠ±2-3´Î£¬Ï´µÓ̉º¾ù×¢ÈëÈƯÁ¿Æ¿ |
B£®³ÆÁ¿¼ÆËă³öµÄÇâÑơ»¯Äƹ̀̀åÓÚÉƠ±ÖĐ£¬ÔÙ¼ÓÈëÉÙÁ¿Ë®£¨Ô¼30mL£©£¬ÓĂ²£Á§°ôÂưÂư½Á¶¯£¬Ê¹Æä³ä·ÖÈܽⲢÀäÈ´ÖÁỂΠ|
C£®½«ÈܽâµÄÇâÑơ»¯ÄÆÈÜ̉ºÑز£Á§°ô×¢Èë500mLµÄÈƯÁ¿Æ¿ÖĐ |
D£®½«ÈƯÁ¿Æ¿¸Ç½ô£¬Ơñµ´£¬̉¡ÔÈ |
E£®¸ÄÓĂ½ºÍ·µÎ¹Ü¼ÓË®£¬Ê¹ÈÜ̉º°¼ĂæÇ¡ºĂÓë¿̀¶ÈÏàÇĐ
F£®¼̀ĐøÍùÈƯÁ¿Æ¿ÄÚĐ¡ĐļÓË®£¬Ö±µ½̉ºĂæ½Ó½ü¿̀¶È2~3cm´¦
£¨4£©ÎïÖʵÄÁ¿Å¨¶ÈÎó²î·ÖÎö£º£῭îÆ«¸ß¡¢Æ«µÍ¡¢Î̃Ó°Ḯ£©
¢ÙÓĂÂËÖ½³ÆÁ¿ÇâÑơ»¯ÄÆ £»
¢Ú¶¨ÈƯʱ£¬ÈôÑÛ¾¦¸©ÊÓ¿̀¶ÈÏߣ¬ỘËùÅäÖƵÄÈÜ̉ºÅ¨¶È½« £»
¢ÛδÀäÈ´µ½ỂξÍ×¢ÈëÈƯÁ¿Æ¿¶¨ÈƯ £»
¢ÜÅäºĂµÄÈÜ̉º×ªÈë¸É¾»µÄÊÔ¼Áƿʱ£¬²»É÷½¦³ö²¿·ÖÈÜ̉º ¡£
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
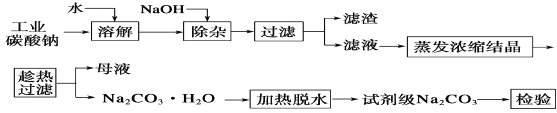
¡¾̀âÄ¿¡¿̀¼ËáÄÆÊÇỐÖ½¡¢²£Á§¡¢·ÄÖ¯¡¢ÖƸïµÈĐĐ̉µµÄÖØ̉ªÔÁÏ¡£¹¤̉µ̀¼ËáÄÆ(´¿¶ÈÔ¼98%)ÖĐº¬ÓĐCa2£«¡¢Mg2£«¡¢Fe3£«¡¢Cl£ºÍSO42£µÈÔÓÖÊ£¬̀á´¿¹¤̉ƠÁ÷³̀ÈçÏ£º
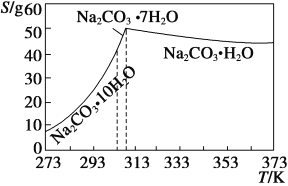
̉ÑÖª̀¼ËáÄƵÄÈܽâ¶È(S)Ëæζȱ仯µÄÇúÏßÈçÏÂͼËùʾ£º
»Ø´đÏÂÁĐÎỀ⣺
£¨1£©ÂËÔüµÄÖ÷̉ª³É·ÖΪ_______________________________¡£
£¨2£©¡°³ĂÈȹưÂË¡±µÄỘ̉ÊÇ___________________________¡£
£¨3£©ÈôÔÚʵÑéỂ½øĐĐ¡°³ĂÈȹưÂË¡±£¬¿É²ÉÈ¡µÄ´ëÊ©ÊÇ_____(Đ´³ö̉»ÖÖ)¡£
£¨4£©̉ÑÖª£ºNa2CO3¡¤10H2O (s)===Na2CO3(s)£«10H2O(g) ¦¤H1£½ +532.36 kJ¡¤mol£1
Na2CO3¡¤10H2O(s)===Na2CO3¡¤H2O(s)£«9H2O(g) ¦¤H2£½ +473.63 kJ¡¤mol£1
Đ´³öNa2CO3¡¤H2OÍÑË®·´Ó¦µÄÈÈ»¯Ñ§·½³̀ʽ____________¡£
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿̀¼»¯¹è£¨SiC£©̀Ơ´É»ù¸´ºÏ²ÄÁÏÊÇ̉»ÖÖĐÂĐÍÈȽṹ²ÄÁÏ¡£ÔÚ¿ƠÆøÖĐ£¬̀¼»¯¹èÄÜÓëÈÛÈÚµÄÇâÑơ»¯ÄÆ·¢Éú·´Ó¦£ºSiC+2NaOH+2O2=Na2SiO3+X+H2O£¬ÏÂÁĐÓĐ¹ØXÎïÖʵĻ¯Ñ§Ê½ÍƶÏÖĐ£¬ƠưÈ·µÄÊÇ( )
A£®SiO2 B£®CO C£®CO2 D£®Na2CO3
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
¡¾̀âÄ¿¡¿ÊµÑéĐè̉ª0£®80 mol¡¤L-1NaOHÈÜ̉º475 mLºÍ0£®40 mol¡¤L-1Ạ́ËáÈÜ̉º500 mL¡£¸ù¾ƯƠâÁ½ÖÖÈÜ̉ºµÄÅäÖÆÇé¿ö»Ø´đÏÂÁĐÎỀ⣺
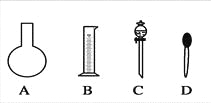
£¨1£©ÈçͼËùʾµÄ̉ÇÆ÷ÖĐÅäÖÆÈÜ̉º¿Ï¶¨²»Đè̉ªµÄÊÇ________£῭îĐ̣ºÅ£©£¬ÅäÖÆÉÏÊöÈÜ̉º»¹ĐèÓõ½µÄ²£Á§̉ÇÆ÷ÊÇ________£῭î̉ÇÆ÷Ăû³Æ£©¡£
£¨2£©ÏÂÁĐ²Ù×÷ÖĐ£¬²»ÄÜÓĂÈƯÁ¿Æ¿ÊµÏÖµÄÓĐ______________£῭îĐ̣ºÅ£©¡£
A£®ÅäÖÆ̉»¶῭å»ư׼ȷŨ¶ÈµÄ±ê×¼ÈÜ̉º |
B£®Á¿È¡̉»¶῭å»ưµÄ̉º̀å |
C£®²âÁ¿ÈƯÁ¿Æ¿¹æ¸ñ̉ÔϵÄÈÎ̉ầå»ưµÄ̉º̀å |
D£®×¼È·Ï¡ÊÍij̉»Å¨¶ÈµÄÈÜ̉º |
E£®Öü´æÈÜ̉º
F£®ÓĂÀ´¼ÓÈÈÈܽâ¹̀̀åÈÜÖÊ
£¨3£©¸ù¾Ư¼ÆËăÓĂÍĐÅ̀̀́ƽ³ÆÈ¡NaOHµÄÖÊÁ¿Îª___________g¡£ÔÚʵÑéÖĐÆäËû²Ù×÷¾ùƠưÈ·£¬Èô¶¨ÈƯʱ¸©ÊÓ¿̀¶ÈÏߣ¬ỘËùµĂÈÜ̉ºÅ¨¶È_________£῭´óÓÚ¡±¡¢¡°µÈÓÚ¡±»̣¡°Đ¡ÓÚ¡±£¬ÏÂͬ£©0£®8 mol¡¤L-1¡£Èô¶¨ÈƯʱ£¬ÓĐÉÙĐíƠôÁóË®È÷ÂäÔÚÈƯÁ¿Æ¿Í⣬ỘËùµĂÈÜ̉ºÅ¨¶È__________0.8 mol¡¤L-1¡£
£¨4£©¸ù¾Ư¼ÆËăµĂÖª£¬ËùĐèÖÊÁ¿·ÖÊưΪ98 %¡¢ĂܶÈΪ1£®84 mol¡¤L-1µÄŨẠ́ËáµÄ̀å»ưΪ__________mL£¨¼ÆËă½á¹û±£Áổ»Î»Đ¡Êư£©¡£Èç¹ûʵÑéỂÓĐ10 mL¡¢15 mL¡¢20 mL¡¢50 mLÁ¿Í²£¬Ñ¡ÓĂ___________mLÁ¿Í²×îºĂ¡£
²é¿´´đ°¸ºÍ½âÎö>>
¹ú¼ÊÑ§Đ£ÓÅÑ¡ - Á·Ï°²áÁбí - ÊỒâÁбí
º₫±±Ê¡»¥ÁªÍøÎ¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨Æ½̀¨ | ÍøÉÏÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | µçĐÅƠ©Æ¾Ù±¨×¨Çø | ÉæÀúÊ·ĐéÎ̃Ö÷̉åÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | ÉæÆóÇÖȨ¾Ù±¨×¨Çø
Î¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨µç»°£º027-86699610 ¾Ù±¨ÓÊÏ䣺58377363@163.com