
【题目】Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:_________。
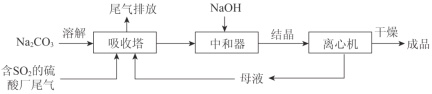
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:![]() IO3-+
IO3-+![]() SO32- =
SO32- =![]() _______ +
_______ +![]() _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
【答案】(1)酸雨(2)2CO32- + SO2 + H2O = 2HCO3- + SO32-
(3)NaHSO3 + NaOH = Na2SO3 + H2O
(4)①Na2SO3存在溶解平衡:Na2SO3(s)![]() 2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;
2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;
(5)BaCl2溶液稀盐酸(6)①![]() IO3- +
IO3- + ![]() SO32- =
SO32- = ![]()
![]() +
+ ![]()
![]() ;②3xy×100%
;②3xy×100%
【解析】
试题分析:(1)向大气中排放SO2会导致酸雨发生;
(2)由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应离子方程式为:2CO32-+SO2+H2O=2HCO3-+SO32-;
(3)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,主要反应化学方程式为:NaHSO3+NaOH=Na2SO3+H2O;
(4)①Na2SO3存在溶解平衡:Na2SO3(s)![]() 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动,抑制Na2SO3溶解;
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动,抑制Na2SO3溶解;
②a.加热蒸发直至蒸干,容易使固体溅出,导致损失等,a错误;b.维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,b正确;c.由于冷却至33℃以下时析出Na2SO37H2O,应在较高温度下蒸发浓缩结晶,c错误,答案选:b;
(5)用盐酸除去亚硫酸钠,防止干扰,再用氯化钡溶液检验硫酸根离子;
(6)①IO3-与SO32-发生氧化还原反应得到SO42-与I-,I元素化合价降低6价,S元素化合价升高2价,化合价升降最小公倍数为6,可得IO3-的系数为1、SO32-的系数为3,配平后离子方程式为:IO3-+3SO32-=3SO42-+I-;
②消耗KIO3的物质的量为y×10-3L×x mol/L=xy×10-3mol,由IO3-+3SO32-=3SO42-+I-,可知n(Na2SO3)=3n(KIO3)=3xy×10-3mol,则成品中Na2SO3的质量分数为![]() ×100%=3xy×100%。
×100%=3xy×100%。


科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
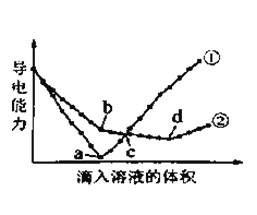
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组成生物体的化学元素中属于微量元素的一组是
A. H、N、P、Mn、C
B. Cl、Fe、S、N、Mg
C. Cu、Zn、Mn、Mo、B
D. Fe、N、P、K、Cu、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关燃料的说法错误的是( )
A.含硫化石燃料的大量燃烧是形成酸雨的主要原因
B.绿色化学的核心就是利用化学原理对工业生产上造成的环境污染进行彻底治理
C.以压缩天然气、液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO![]() +2SO
+2SO![]() ==2SO
==2SO![]() +Cl的平衡常数K表达式为__________。
+Cl的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH(aq)==SO![]() (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO(aq)+SO![]() (aq)==SO
(aq)==SO![]() (aq)+Cl(aq)ΔH2
(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO![]() (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO(aq)+2OH(aq)==CaSO4(s)+H2O(l)+Cl(aq)的ΔH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中大球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_________。
(6)若晶胞的棱长为a cm ,则R2M晶体的密度为=___________g·cm–3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列小实验不能成功的是( )
A. 用活性炭将硬水软化 B. 用紫卷心菜自制酸碱指示剂
C. 用食醋制无壳鸡蛋 D. 用灼烧闻气味的方法区分棉纤维和羊毛纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
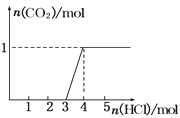
A.通入的CO2气体为22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com