
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发 现电流表指针偏转,下列有关描述正确的是
现电流表指针偏转,下列有关描述正确的是

A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,石墨电极作正极
D.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=== 2Cl-
科目:高中化学 来源: 题型:
将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 97.5 g
C.气体A中SO2和H2的体积比为4∶1
D.反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:M(g)+ N(g)  R(g)+2L此反应符合右图,下列叙述正确的是
R(g)+2L此反应符合右图,下列叙述正确的是
A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是气体 D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
B.乙酸与碳酸钠溶液反应:2CH3COOH+CO32— CO2↑+H2O+2CH3COO—
CO2↑+H2O+2CH3COO—
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O— 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
D.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
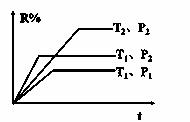
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是

A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为 0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。712g“可燃冰”(若分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 ▲ kJ。
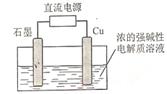 (2)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为2Cu+H2O
(2)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为2Cu+H2O Cu2O+H2
Cu2O+H2 。该电解池中,铜电极接直流电源的 ▲ 极(填“正”或“负”);
。该电解池中,铜电极接直流电源的 ▲ 极(填“正”或“负”);
每生成1molCu2O,电路中通过的电子的数目为 ▲ ;
该电解池的阴极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)。

请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
取样,滴加KSCN溶液,溶液呈血红色,则黄色溶液中阳离子为Fe3+
(3)I与氯气反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
Al2O3+2NaOH=2NaAlO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是
A.常温时,A能从水中置换出氢,而B不能
B.A原子电子层数比B原子的电子层数多
C.1 mol A 与足量的酸反应生成的H2比1 mol B生成的H2多
D.A原子的最外层电子数比B原子的最外层电子数少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com