
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。
I.铅的冶炼
一种用铅矿石(主要成分为PbS)冶炼铅的改进工艺流程如下图所示。

(1)浮选前将铅矿石破碎的目的是____________________
(2)反应器氧化段的主要反应有2PbS+3O2![]() 2PbO+2SO2(反应a)和PbS+2PbO
2PbO+2SO2(反应a)和PbS+2PbO![]() 3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
(3)该工艺流程与传统方法相比优点之一就是可得到富SO2烟气,富SO2烟气可直接用于某种工业生产,请写出表示该工业生产的原理的化学方程式_________、________。
Ⅱ.含铅废水处理
化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清。

(4)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为______。pH![]() 13时,溶液中发生的主要反应的离子方程式为________________________。
13时,溶液中发生的主要反应的离子方程式为________________________。
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致_____。已知Ksp (PbS) =8.0![]() 10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0
10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0![]() 10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
【答案】增大铅矿石和浮选剂的接触面积,提高浮选效率 O2 1∶3 2SO2 + O2 ![]() 2SO3 SO3+ H2O =H2SO4 10(9.5-10均可) Pb(OH)3-+ OH-= Pb(OH)42- 产生大量H2S,造成污染 已经
2SO3 SO3+ H2O =H2SO4 10(9.5-10均可) Pb(OH)3-+ OH-= Pb(OH)42- 产生大量H2S,造成污染 已经
【解析】
(1)根据浮选主要是利用物理性质对矿石进行富集分析解答;
(2)反应a:2PbS+3O2![]() 2PbO+2SO2中氧气中的O元素化合价降低;反应b:PbS+2PbO
2PbO+2SO2中氧气中的O元素化合价降低;反应b:PbS+2PbO![]() 3Pb+SO2中S元素化合价升高,Pb元素化合价降低,据此分析解答;
3Pb+SO2中S元素化合价升高,Pb元素化合价降低,据此分析解答;
(3)富SO2烟气可直接用于工业生产硫酸,据此书写工业生产硫酸的原理;
(4)根据水溶液中各形态铅的百分含量x与溶液pH变化的关系图,在pH=10左右时,主要形成氢氧化铅沉淀;pH![]() 13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,据此书写反应的方程式;
13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,据此书写反应的方程式;
(5)若溶液pH过低,表示溶液的酸性太强,Na2S会与酸反应放出H2S;根据Ksp (PbS) 计算c(Pb2+),再计算该废水中铅含量,与国家规定的排放标准相比较。
I. (1)浮选主要是利用物理性质对矿石进行富集,因此破碎的目的是为了增大铅矿石和浮选剂的接触面积,提高浮选效率,故答案为:增大铅矿石和浮选剂的接触面积,提高浮选效率;
(2)反应a:2PbS+3O2![]() 2PbO+2SO2中氧气中的O元素化合价降低,为氧化剂;反应b:PbS+2PbO
2PbO+2SO2中氧气中的O元素化合价降低,为氧化剂;反应b:PbS+2PbO![]() 3Pb+SO2中S元素化合价升高,Pb元素化合价降低,氧化产物为SO2,还原产物为Pb,氧化产物和还原产物的物质的量之比为1∶3,故答案为:O2;1∶3;
3Pb+SO2中S元素化合价升高,Pb元素化合价降低,氧化产物为SO2,还原产物为Pb,氧化产物和还原产物的物质的量之比为1∶3,故答案为:O2;1∶3;
(3)富SO2烟气可直接用于工业生产硫酸,工业生产硫酸的原理为2SO2 + O2 ![]() 2SO3;SO3+ H2O =H2SO4,故答案为:2SO2 + O2
2SO3;SO3+ H2O =H2SO4,故答案为:2SO2 + O2 ![]() 2SO3;SO3+ H2O =H2SO4;
2SO3;SO3+ H2O =H2SO4;
Ⅱ. (4)若采用氢氧化物沉淀法除溶液中的Pb2+,根据水溶液中各形态铅的百分含量x与溶液pH变化的关系图,在pH=10左右时,主要形成氢氧化铅沉淀,应将溶液的pH调至约为10;pH![]() 13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子反应结合生成Pb(OH)42-,反应的离子方程式为Pb(OH)3-+ OH-= Pb(OH)42-,故答案为:10;Pb(OH)3-+ OH-= Pb(OH)42-;
13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子反应结合生成Pb(OH)42-,反应的离子方程式为Pb(OH)3-+ OH-= Pb(OH)42-,故答案为:10;Pb(OH)3-+ OH-= Pb(OH)42-;
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低,溶液的酸性太强,Na2S会与酸反应放出H2S,造成污染;废水中S2-浓度为2.0![]() 10-20mol/L,根据Ksp (PbS) =8.0
10-20mol/L,根据Ksp (PbS) =8.0![]() 10-28,c(Pb2+)=
10-28,c(Pb2+)=![]() =4.0
=4.0![]() 10-8 mol/L,1L该废水中铅含量=(4.0×10-8×207×1000)mg=8.28×10-3 mg,即该废水中铅含量为8.28×10-3 mg/L<0.5mg/L,已经达到国家规定的排放标准,故答案为:产生大量H2S,造成污染;已经。
10-8 mol/L,1L该废水中铅含量=(4.0×10-8×207×1000)mg=8.28×10-3 mg,即该废水中铅含量为8.28×10-3 mg/L<0.5mg/L,已经达到国家规定的排放标准,故答案为:产生大量H2S,造成污染;已经。


科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期主族元素,其常见单质存在如图的转化关系(未注明反应条件),甲(常温下呈液态)、乙是两种常见的化合物。X的原子半径是同周期主族元素原子中最小的,W与X同主族,W的最髙价氧化物对应的水化物是一种强酸。下列说法不正确的是( )

A. 简单离子的半径:W>Y>X
B. 化合物乙是强电解质
C. 化合物WY2可作漂白剂
D. 常温下,乙溶于甲中所得的溶液能蚀刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0
C2H4(g)+4H2O(g) ΔH<0

(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=_________kJ·mol1。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的ΔH= 152 kJ·mol1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | O-H |
键能/(kJ·mol-1) | 803 | 436 | x | 414 | 463 |
(3)向1 L恒容密闭容器中通入1 mol CO2和n mol H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比X[ n(H2)/n(CO2 )]的关系如图所示。

①X1_________(填“>”、“<”或“=”,下同)X2;
②平衡常数KA_______KB,KB________KC;
③若B点时X=3,则平衡常数KB=_____________(代入数据列出算式即可);
④下列措施能同时满足增大反应速率和提高CO2转化率的是(__________)
a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来

(4)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则N极上的电极反应式为:_______________;该电解池中所发生的总反应的化学方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中一lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是

A. 常温下Ksp (CuS)的数量级为10-35
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为______,基态Mn3+含有的未成对电子数是______。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是________,与NO3-互为等电子体的分子的化学式为__________(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
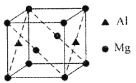
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为_______,晶体中每个镁原子周围距离最近的铝原子数目为_______,该晶体的密度为______g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值, 下列叙述正确的是
A. 1mol H2O中含有的极性共价键数目为2NA
B. 16 g16O2和18O2混合物中含有的质子数目为8NA
C. Zn和浓硫酸反应得到22.4LSO2和 H2混合气体时, 转移的电子数为4NA
D. 标准状况下2 mol NO与1 mol O2充分反应后分子数共2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:

已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为__________________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中______(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_________、_________、过滤。
(5)该厂生产的Ba(NO3)2晶体含有少量Cu2+。化学上通过惰性电极电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成。生成该气体的电极反应为______________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为___________;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com